Дифференциация метоксибензоилпиперазинов (OMeBzPs) и метилендиоксибензилпиперазинов (MDBP) методами ГХ-ИРД и ГХ- МС
Разработанный препарат 3,4-метилендиоксибензилпиперазин (3,4-МДБФ), его позиционный изомер 2,3-метилендиоксибензилпиперазин (2,3-МДБФ) и три региоизомерных циклозамещенных метоксибензоилпиперазина (OMeBzPs) имеют идентичный элементный состав и не имеют заметных различий в их масс-спектры содержат только три региоизомера метоксибензоилпиперазина, показывающие один уникальный основной фрагментный ион с m/z 152.
Перфторацилирование вторичного аминного азота этих изомерных пиперазинов дало масс-спектры с различиями в относительном содержании некоторых фрагментных ионов, но не изменило фрагментацию. путь предоставления уникальных ионов для дискриминации этих изомеров.
Точное определение массы с использованием газовой хроматографии в сочетании с времяпролетной масс-спектрометрией (ГХ-ВП-МС) не позволило различить эти соединения, поскольку основные ионы-фрагменты имеют идентичный элементный состав.
Газовая хроматография в сочетании с инфракрасным обнаружением (GC-IRD) обеспечивает прямые подтверждающие данные для идентификации карбонилсодержащих соединений и дифференциации психоактивного дизайнерского препарата 3,4-MDBP от его прямого (2,3-MDBP) и непрямого (OMeBzPs) ) региоизомеры.
Масс-спектры в сочетании с инфракрасными спектрами паровой фазы обеспечивают конкретное подтверждение существования каждого из изомерных пиперазинов.
Нериватизированные и перфторацильные производные формы пяти пиперазинов, участвовавших в этом исследовании, были разделены на неподвижной фазе 100% трифторпропилметилполисилоксана (Rtx-200). Авторские права © 2011 John Wiley & Sons, Ltd.
Введение
Ряд производных пиперазина недавно появился на рынке запрещенных наркотиков и представляет собой новую группу дизайнерских наркотиков. Известно, что некоторые соединения типа 1-арилпиперазина обладают хорошим сродством к связыванию с серотониновыми рецепторами центральной нервной системы человека.
Это сродство становится более селективным с помощью соответствующих заместителей в ароматическом кольце.
Сообщается, что наиболее часто злоупотребляемыми соединениями этой группы являются N-бензилпиперазин и 3-трифторметилфенил пиперазин (3-TFMPP). И N-бензилпиперазин, и 3-TFMPP были внесены в Список 1 Закона США о контролируемых веществах в сентябре 2002 года.
Недавно было описано, что 3,4-метилендиоксибензилпиперазин (3,4-MDBP) оказывает психоактивное действие, подобное эффектам 3,4-метилендиоксибензилпиперазина (3,4-MDBP). ,4-метилендиоксиметамфетамин (МДМА).
Некоторые из этих соединений пиперазина коммерчески доступны и еще не находятся под особым юридическим контролем.
Сообщалось, что 3,4-метилендиоксибензилпиперазин (3,4-MDBP; пиперонилпиперазин) является потенциальным наркотиком, вызывающим злоупотребление, тогда как фармакология его 2,3-региоизомера еще не известна.
Действительно, анализ 3,4-MDBP в биологических и судебно-медицинских образцах был в центре внимания нескольких исследований в последние годы.
Недавний отчет показал, что 3,4-MDBP невозможно отличить от его 2,3-региоизомера с помощью масс-спектрометрии даже после химической дериватизации.
Однако газовая хроматография в сочетании с инфракрасным обнаружением (GC-IRD) позволила различить эти два соединения на основе различий в положении и интенсивности их ИК-полос пропускания.
В других отчетах описываются исследования с помощью ГХ-ИКД и газовой хроматографии-масс-спектрометрии (ГХ-МС) двух региоизомерных замещенных по кольцу метилендиоксибензилпиперазинов и их изобарных замещенных по кольцу метоксиметилбензилпиперазинов и этоксибензилпиперазинов, предлагающих методы распознавания между этими соединениями.
ГХ-МС является наиболее часто используемым методом анализа контролируемых веществ в судебно-медицинских лабораториях.
Идентификация психоактивных веществ по ряду химических категорий осложняется наличием региоизомерных и изобарных веществ, родственных целевому препарату.
Эти изомерные вещества представляют собой проблему для судебно-медицинского анализа, который должен во многом зависеть от масс-спектрометрии для получения данных об уровне подтверждения.
Эти региоизомерные и изобарные вещества имеют одинаковую номинальную массу и дают практически идентичные масс-спектры.
Предыдущие исследования показали, что методы химической дериватизации (в первую очередь перфторацилирования) могут успешно применяться для дискриминации многих изомерно родственных соединений.
Дериватизация может изменить основные пути фрагментации, часто предоставляя дополнительную структурную информацию об отдельном изомере, а также изменяя хроматографические свойства.
Однако в некоторых случаях дериватизация не дает характерных ионов масс-спектральных фрагментов для отдельных изомеров.
Инфракрасная спектроскопия считается методом подтверждения идентификации органических соединений из-за уникальности инфракрасных спектров очень похожих органических молекул.
ГХ-ИКД характеризуется достаточно быстрым сканированием для получения ИК-спектров паровой фазы соединений, элюируемых из капиллярной колонки ГХ.
Этот метод успешно использовался для идентификации изомеров амфетамина, а также региоизомеров боковой цепи, родственных метамфетамину и фентермину. Недавно были описаны исследования GC-IRD для дифференциации этоксифенэтиламинов с замещением по кольцу и боковой цепи, метоксиметкатинонов и метилендиоксиметамфетаминов.
Три замещенных по кольцу метоксибензоилпиперазина имеют непрямую региоизомерную связь с 2,3 и 3,4-МДБФ. Косвенные региоизомеры — это те, которые имеют одинаковую номинальную и точную массу, но имеют разное расположение атомов в своей химической структуре.
Замещение метоксигруппы в положениях 2, 3 и 4 ароматического кольца дает три возможных соединения бензоилпиперазина с замещением в кольце.
Метоксибензоил-(C8H7O2)-замещенные пиперазины имеют косвенное региоизомерное родство с метилендиоксибензил-замещенными пиперазинами.
Отсутствие аналитических эталонных стандартов для этих соединений затрудняет их идентификацию и распознавание в судебной химии наркотиков.
В этом отчете будут описаны исследования GC-IRD и GC-MS двух региоизомерных замещенных по кольцу метилендиоксибензилпиперазинов и их непрямых региоизомерных замещенных по кольцу метоксибензоилпиперазинов с целью предложить методы распознавания среди всех этих соединений.
Экспериментальный
Инструментарий
Анализ ГХ-МС проводился с использованием газового хроматографа 7890A с автоматическим инжектором 7683B, соединенным с масс-селективным детектором 5975 C VL, приобретенным у Agilent Technologies (Санта-Клара, Калифорния, США).
Скорость масс-спектрального сканирования составляла 2,86 скан/с. ГХ работал в режиме без деления потока со скоростью потока гелия (класс 5) 0,7 мл/мин и давлением в головке колонки 10 фунтов на квадратный дюйм.
МС работал в режиме электронного удара (ЭУ) с использованием напряжения ионизации 70 эВ и температуры источника 230°С. Инжектор ГХ поддерживался при 250°С, а линия переноса - при 280°С. Хроматографическое разделение осуществлялось с использованием капиллярная колонка длиной 30 м с внутренним диаметром 0,25 мм, покрытая 0,50 мм 100% трифторпропилметилполисилоксаном (Rtx-200).
Разделение пентафторпропионильных и гептафторбутирильных производных проведено.
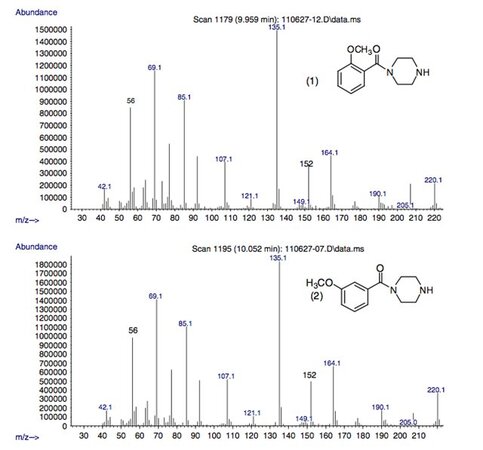
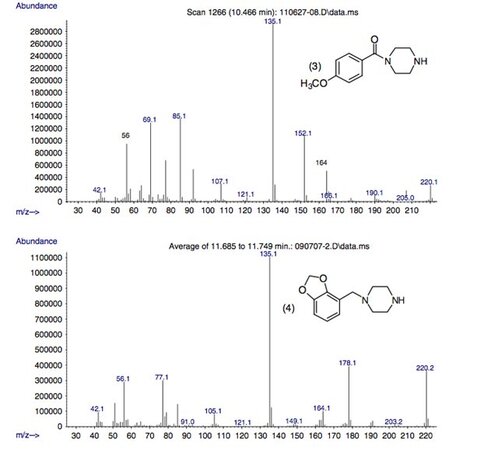
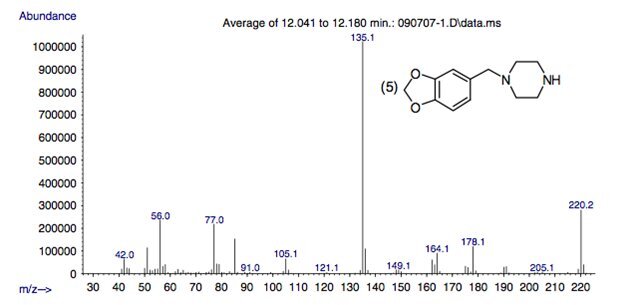
Рисунок 1.
Масс-спектры дериватизированных метоксибензоилпиперазинов и метилендиоксибензилпиперазинов в данном исследовании.
проводили с использованием температурной программы, состоящей из начальной температуры 70°С в течение 1 минуты, постепенного повышения до 250°С со скоростью 30°С/мин с последующим выдерживанием при 250°С в течение 15 минут.
Анализ ГХ-ВП проводился в Центре масс-спектрометрии Обернского университета.
Для анализа использовали газовый хроматограф 6890N с автоматическим инжектором 7683B, приобретенным у Agilent Technologies (Санта-Клара, Калифорния, США), соединенный с Waters GCT.
Настольный времяпролетный масс-спектрометр с ортогональным ускорением Premier (oa-TOF).
Хроматографический анализ проводили с использованием капиллярной колонки длиной 30 м с внутренним диаметром 0,25 мм, покрытой пленкой неподвижной фазы толщиной 0,50 мм, колонки DB5-MS (J&W Scientific).
Температурная программа состояла из начальной температуры 70°С в течение 1 мин, постепенного повышения до 250°С со скоростью 15°С/мин с последующим выдерживанием при 250°С в течение 7 мин.
Идентификация была подтверждена анализом элементного состава с использованием точного измерения массы с внутренним калибрантом (lockmass 118,9919 m/z, гептакосафтортрибутиламин, Sigma) с допустимой погрешностью менее 5 ppm и изотопным моделированием, сравнивающим экспериментальное и теоретическое распределение изотопов.
Исследования ГХ-ИКД проводились с использованием газового хроматографа Hewlett-Packard 5890 Series II и автоинжектора Hewlett-Packard 7673, соединенного с инфракрасным детектором IRD-II (IRD-II), полученным от Analytical Solutions and Providers (ASAP), ( Ковингтон, Кентукки, США). Инфракрасные спектры паровой фазы записывались в диапазоне 4000–650 см-1 с разрешением 8 см-1 и скоростью сканирования 1,5 сканирований в секунду.
Температуру проточной ячейки IRD и линии передачи поддерживали на уровне 280°С, а ГХ работал в режиме без разделения со скоростью потока газа-носителя (гелий класса 5) 0,7 мл/мин и давлением в головке колонки 10 фунтов на квадратный дюйм.
Используемая капиллярная колонка представляла собой 30-метровую колонку с внутренним диаметром 0,25 мм, покрытую 0,50 мм смеси 50% фенил-50% метилполисилоксан (Rxi-50).
Температурная программа, использованная в этом исследовании, состояла из начальной температуры 70°С в течение 1 минуты, постепенного повышения до 230°С со скоростью 20°С в минуту с последующим выдерживанием при 230°С в течение 15 минут.
Капиллярная колонка, использованная в этих исследованиях, была приобретена у Restek Corporation (Беллефонте, Пенсильвания, США).
В анализах ГХ-МС и ГХ-ИКД образцы растворяли и разбавляли в ацетонитриле класса ВЭЖХ (Fisher Scientific, Фэрлон, Нью-Джерси, США) и вводили индивидуально или в физических смесях через автоматические инжекторы, используя объем впрыска 1 мл.
Лекарственные препараты и реагенты
Общая процедура синтеза двух региоизомерных бензилпиперазинов включает восстановительное аминирование соответствующим образом замещенного бензальдегида и пиперазина в присутствии цианборгидрида натрия.
Выделение основной фракции дало соответствующие бензилпиперазиновые основания, которые превратили в соответствующий гидрохлорид.
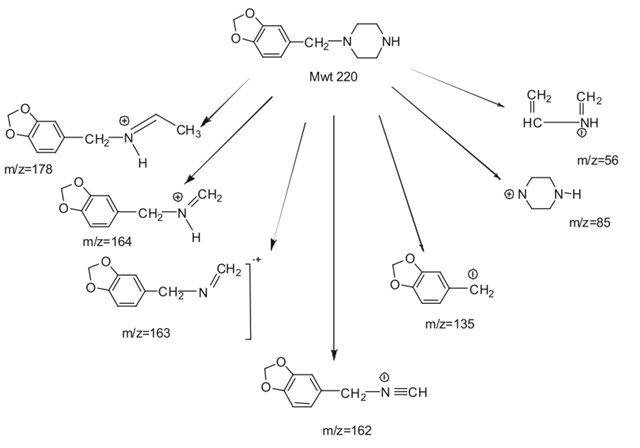
Рисунок 2.
Масс-спектральная картина фрагментации невариватизированного 3,4-метилендиоксибензилпиперазина в условиях ЭУ (70 эВ).
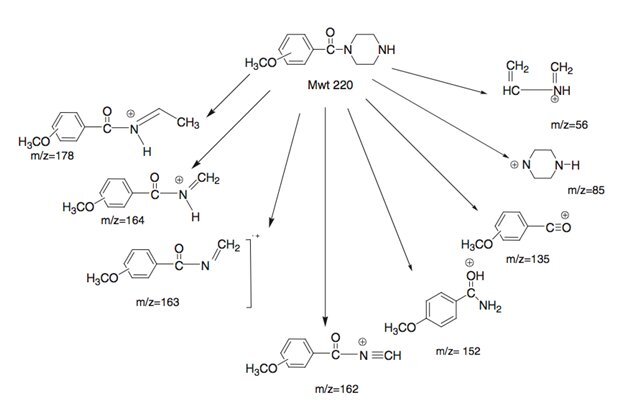
Рисунок 3.
Масс-спектральная картина фрагментации невариватизированных метоксибензоилпиперазинов в условиях ЭУ (70 эВ).
соли с использованием газообразной HCl и очищают перекристаллизацией.
Общая процедура синтеза трех региоизомерных метоксибензоилпиперазинов включает медленное добавление соответствующим образом замещенного бензоилхлорида к раствору пиперазина в дихлорметане на ледяной бане.
Выделение основной фракции дало соответствующие бензоилпиперазиновые основания, которые с помощью газообразной HCl переводили в соответствующие гидрохлоридные соли и очищали перекристаллизацией.
Исходными веществами для соединений 1, 2 и 3 являются 2, 3 и 4-метоксибензоилхлорид соответственно, а исходным веществом для соединения 5 является 3,4-метилендиоксибензальдегид (пиперональ), и все они коммерчески доступны. 2,3-метилендиоксибензальдегид является исходным материалом для 2,3-МДБФ (соединение 4), и о его получении сообщалось ранее.
Все лабораторные реагенты и растворители были получены от Aldrich Chemical Co. (Милуоки, Висконсин, США) или Fisher Scientific (Атланта, Джорджия, США). Реагенты для дериватизации трифторуксусный ангидрид (TFA), пентафторпропионовый ангидрид (PFPA) и гептафтормасляный ангидрид (HFBA) были приобретены у Sigma-Aldrich, Inc. (Милуоки, Висконсин, США).
Процедура дериватизации
Каждый перфторамид готовили индивидуально путем растворения примерно 0,3 мг (1,36 · 10–6 моль) каждой гидрохлоридной соли амина в 50 мл этилацетата с последующим добавлением большого избытка (250 мл) соответствующего дериватизирующего агента (ТФУ или ПФПА). или HFBA), и реакционные смеси инкубировали в пробирках с крышками при 70°С в течение 20 мин.
После инкубации каждый образец выпаривали досуха под током воздуха при 55°C и восстанавливали 200 мл этилацетата и 50 мл пиридина. Порцию каждого конечного раствора (50 мл) разбавляли ацетонитрилом для ВЭЖХ (200 мл) с получением рабочих растворов.
Результаты и обсуждение
Масс-спектральные исследования
Масс-спектрометрия является основным методом подтверждения идентичности наркотиков в пробах судебно-медицинской экспертизы. На рис. 1 показана масса ЭИ.
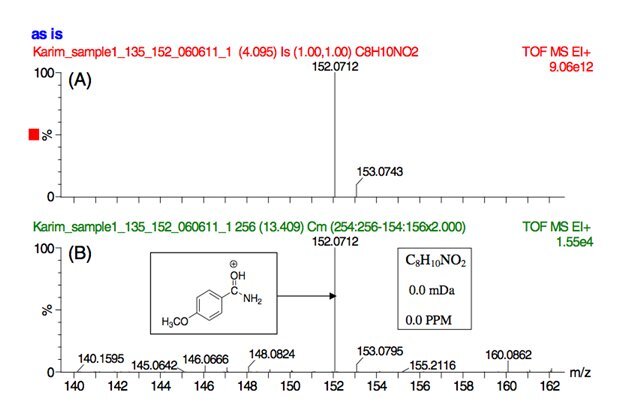
Рисунок 4.
Масс-спектральный анализ ГХ-ТОФ иона m/z 152 для 4-метоксибензоилпиперазина. (А) расчетная масса C8H10NO2; (B) экспериментальные результаты.
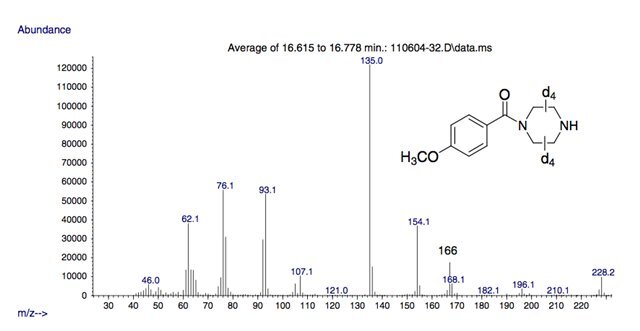
Рисунок 5.
Масс-спектр 4-метоксибензоил-d8-пиперазина.
спектры всех пяти изомерных пиперазинов (соединения 1–5).
Ионы значительного относительного содержания, общие для пяти изомеров, вероятно, возникают в результате фрагментации пиперазинового кольца.
Масс-спектры пяти пиперазинов содержат фрагментные ионы с m/z 178, 164, 135, 85 и 56, а также другие ионы с низким относительным содержанием.
Предлагаемые структуры этих фрагментных ионов показаны на рисунках 2 и 3 и основаны на предыдущем отчете, описывающем фрагментацию незамещенных бензилпиперазинов.
Региоизомерные метоксибензоильные фрагменты (C8H7O2)+ имеют те же номинальные и точные массы, что и метилендиоксибензильные катионы (C8H7O2)+, встречающиеся при m/z 135.
Масс-спектры циклозамещенных метоксибензоилпиперазинов (соединения 1–3) имеют практически идентичные масс-спектры с друг к другу и к изомерам метилендиоксибензилпиперазина
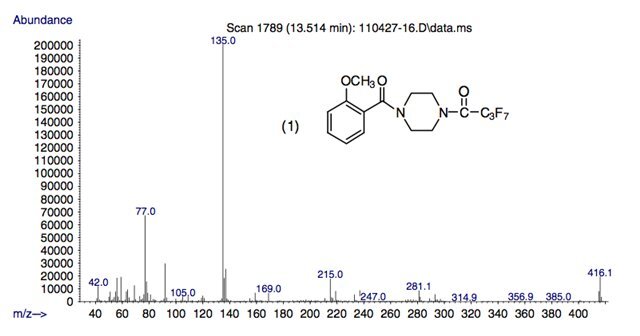
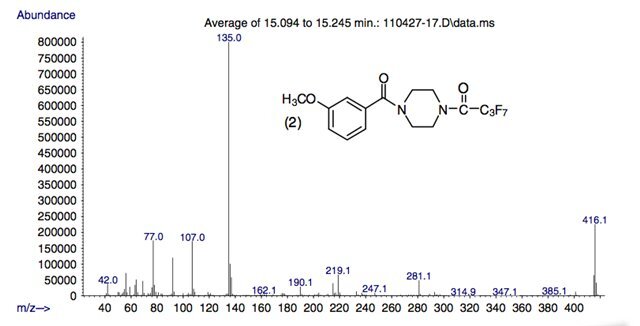
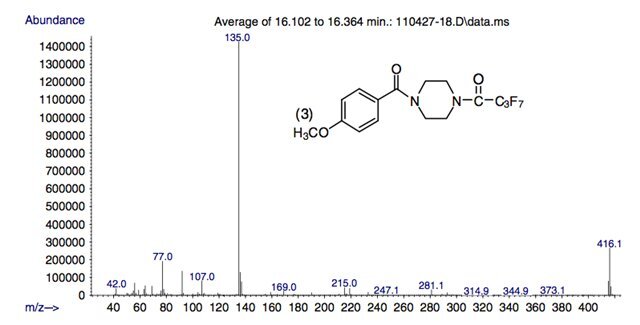
Рисунок 6.
Масс-спектры гептафторбутириловых производных трех метоксибензоилпиперазинов в этом исследовании.
(соединения 4 и 5), за исключением характерного высокого относительного содержания иона с m/z 152, который, по-видимому, специфичен для трех региоизомерных метоксибензоилпиперазинов.
Точный масс-анализ методом ГХ-ВП-МС подтвердил уникальный ион m/z 152 в региоизомерных бензоилпиперазинах (соединения 1–3) элементного состава C8H10NO2.
На рис. 4 показаны точные результаты измерения массы иона m/z 152 в 4-метоксибензоилпиперазине.
Верхняя панель (А) показывает ожидаемую/расчетную массу для элементного состава C8H10NO2, а нижняя панель (Б) показывает экспериментальные результаты вместе со степенью согласия (0,0 мДа, 0,0 ppm) между расчетными и экспериментальными результатами.
Предполагаемая структура иона m/z 152 C8H10NO2 показана на рисунке 4.
Предполагаемая структура этого фрагмента включает образование протонированного метоксибензамида.
Предложенная структура иона m/z 152 подтверждается масс-спектром октадейтромеченой формы 4-метоксибензоилпиперазина (4-метоксибензоил-d8-пиперазина).
Это меченное октадейтерием соединение было получено путем медленного добавления 4-метоксибензоилхлорида к раствору d8-пиперазина в дихлорметане на ледяной бане.
Масс-спектр меченной дейтерием формы соединения 3 показан на рисунке 5 и указывает на то, что два атома дейтерия остаются в составе рассматриваемого иона, поскольку в этом случае масса увеличилась на 2 Да до m/z 154.
Второй этап этого исследования включал получение и оценку перфторацильных производных изомерных пиперазинов с целью индивидуализации их масс-спектров и идентификации дополнительных уникальных ионов-маркеров для дифференциации между этими пятью соединениями. Ацилирование снижает основность азота и может позволить другим путям фрагментации играть более заметную роль в результирующих масс-спектрах.
Трифторацетильные, пентафторпропионильные и гептафторбутриловые производные вторичного азота оценивали на способность индивидуализировать масс-спектры этого ряда замещенных пиперазинов.
На рисунке 6 показаны масс-спектры гептафторбутриламидов трех метоксибензоилпиперазинов как представителей всех перфторацилированных пиперазинов, оцененных в этом исследовании.
Спектры производных ГФБА соединений 4 и 5 представлены ранее. Молекулярные ионы амидов TFA, PFPA и HFBA дают пики высокой относительной распространенности при m/z 316, 366 и 416 соответственно.
Основной фрагментный ион в этих спектрах находится при m/z 135 и соответствует замещенным в кольце бензильным или бензоильным катионам.
Кроме того, дополнительная серия фрагментных ионов, встречающаяся при m/z 181, 231 и 281 для амидов TFA, PFPA и HFBA соответственно, соответствует
Масс-спектральный анализ методом ГХ-ТОФ иона m/z 135 для 4-метоксибензоилпиперазина и 3,4-метилендиоксибензилпиперазина. (А) расчетная масса C8H7O2; (B) экспериментальные результаты. (C) расчетная масса C8H7O2; (D) результаты экспериментов.
Ион (М-135)+ для каждого амида. Эти ионы имеют более высокие относительные содержания в масс-спектрах производных метилендиоксибензилпиперазинов по сравнению с масс-спектрами метоксибензоилпиперазинов.
Ион с m/z 219 наблюдался в спектрах всех производных и, вероятно, образовался в результате отщепления перфторацильного фрагмента.
Ионы, встречающиеся при m/z 69, 119 и 169, представляют собой перфторалкильные катионы трифторметил, пентафторэтил или гептафторпропил из соответствующих амидов.
Эти исследования показывают, что химическая дериватизация (перфторацилирование) не дает каких-либо дополнительных уникальных маркерных ионов, позволяющих идентифицировать одно соединение при исключении других в этом наборе соединений.
Изомерные метоксибензоильные фрагменты (C8H7O2)+ имеют те же номинальные и точные массы, что и метилендиоксибензильный катион (C8H7O2)+, встречающийся при m/z 135. На рисунке 7 показан точный массовый анализ 4-метоксибензоила и 3, полученный методом ГХ-ТОФ-МС. 4-метилендиоксибензильный катион (m/z = 135) для соединений 3 и 5 соответственно. Верхняя панель (А) показывает ожидаемую/расчетную массу для элементного состава C8H7O2. На нижней панели (Б) показаны результаты эксперимента и степень согласия (-0,2 мДа) с расчетной массой.
Таким образом, подтверждая ион m/z 135 в соединении 3 как элементный состав C8H7O2.
Эти результаты можно сравнить с точным масс-анализом иона m/z 135 (3,4-метилендиоксибензильного катиона) в соединении 5. Рисунки 7C и 7D подтверждают элементный состав как C8H7O2 с отклонением массы 0,8 мДа.
Таким образом, точное измерение массы не различает эти косвенно региоизомерные формы иона (C8H7O2)+ m/z 135 и не дает каких-либо дискриминационных преимуществ перед обычным методом ГХ-МС.
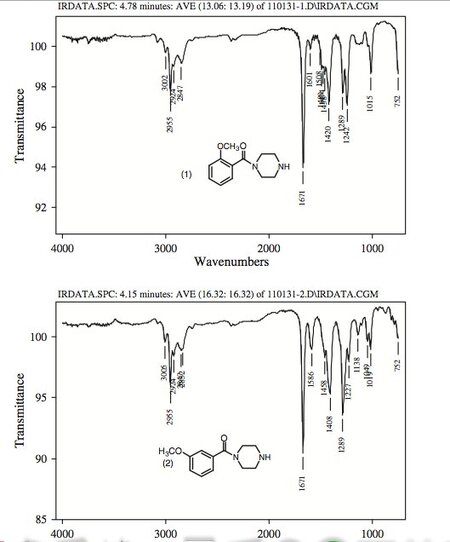
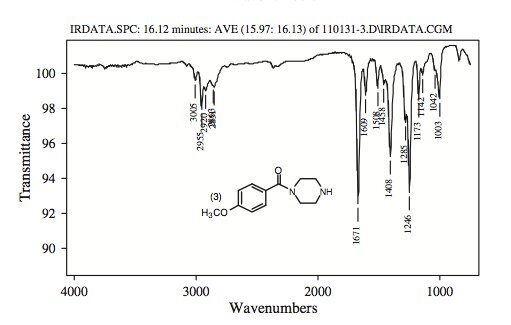
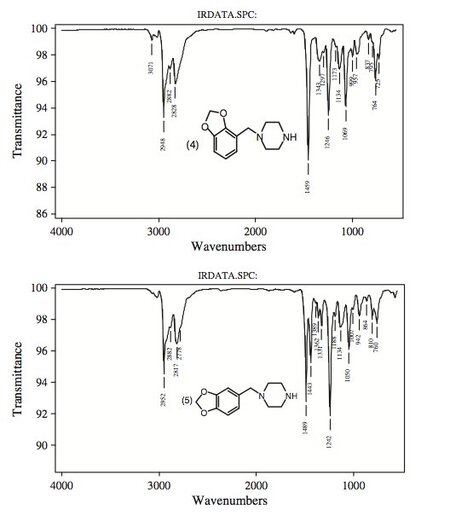
Рисунок 8.
ИК-спектры паровой фазы пяти пиперазинов, участвовавших в этом исследовании.
Инфракрасная спектроскопия паровой фазы
Инфракрасная спектроскопия часто используется в качестве подтверждающего метода идентификации соединений при судебно-медицинской экспертизе наркотиков.
GC-IRD оценивали на предмет дифференциации пяти изомерных пиперазинов.
Инфракрасные спектры паровой фазы пяти пиперазинов показаны на фигуре 8 .
Спектры были получены в паровой фазе после введения образца в газовый хроматограф, и каждое соединение показывает полосы пропускания в областях 650–1700 см-1 и 2700–3100 см-1.
В целом изменения в характере замещения ароматического кольца приводят к изменениям в ИК-области от 650 до 1700 см-1.
Однако изменения в структуре боковой цепи часто приводят к изменениям в области 2700–1700 см-1.[23]
Поскольку пять пиперазинов имеют одинаковую степень замещения азота, т.е. одну и ту же боковую цепь, они имеют практически идентичные ИК-спектры в области 2700–3100 см-1.
Однако их легко отличить по положению и интенсивности нескольких ИК-пиков в области 650–1700 см-1.
Три региоизомерных метоксибензоилпиперазина имеют характерную сильную синглетную ИК-полосу при 1671 см-1, соответствующую растяжению карбонильной группы, которая позволяет отличить эти три бензоилпиперазина от двух метилендиоксибензилпиперазинов.
Три замещенных по кольцу бензоилпиперазина имеют почти одинаковые ИК-характеристики в области 2700–3100 см-1.
Однако их можно отличить по положению и интенсивности нескольких ИК-пиков в области 650–1700 см-1.
Соединение 3 демонстрирует сильный пик при 1246 см-1, который смещается к дублету средней интенсивности при 1289 см-1, 1242 см-1 в соединении 1 и сильному синглету при 1289 см-1 в соединении 2. Соединение 1 демонстрирует сильный пик. при 1420 см-1, который сдвинут к пику при 1408 см-1 как в соединениях 2, так и в 3. Соединение 3 также имеет пик средней интенсивности при 1003 см-1, который сдвинут к пику при 1015 см-1 в соединении 1 и слабый синглет при 1019 см-1 в соединении 2.
Региоизомер 2,3-МДБФ (соединение 4) характеризуется полосой средней интенсивности при 764 см-1, которая в региоизомере 3,4-МДБФ расщеплена на дублетные пики слабой и равной интенсивности при 760 и 810 см-1. (соединение 5).
Кроме того, в ИК-спектре 2,3-изомера наблюдаются другие слабые дублетные пики при 957 и 999 см-1, которые для 3,4-МДБФ смещены в синглет при 942 см-1.
Региоизомер 2,3-MDBP имеет относительно сильную ИК-полосу при 1069 см-1, которая у 3,4-региоизомера смещена к пику средней интенсивности при 1050 см-1.
ИК-спектр паровой фазы региоизомера 3,4-МДБФ можно отличить от спектра 2,3-региоизомера по крайней мере тремя ИК-полосами различной интенсивности.
Первым является пик сильной интенсивности при 1242 см-1 по сравнению с пиком промежуточной интенсивности при 1246 см-1 в 2,3-изомере. Второй представляет собой дублетный пик поглощения слабой интенсивности при 1331 и 1362 см-1, который проявляется как очень слабый дублет при 1297 и 1343 см-1 в 2,3-изомере.
Третий - сильный дублетный пик 3,4-МДБФ, появляющийся при 1443 и 1489 см-1.
Первое имеет почти половину интенсивности второго.
Это было эквивалентно появлению очень сильного синглета при 1459 см-1 в 2,3-региоизомере без эквивалентной полосы при 1443 см-1.

Рисунок 9.
Газохроматографическое разделение (A) пентафторпропионильных производных и (B) гептафторбутириловых производных пяти пиперазинов с использованием колонки Rtx-200.
Эти результаты служат прекрасной иллюстрацией ценности ИК-подтверждения паровой фазы региоизомерных веществ в этом исследовании. Полученные ИК-спектры показывают значительные различия в основных полосах этих пяти соединений.
Газовая хроматография.
Газохроматографическое разделение дериватизированных и дериватизированных пиперазинов осуществляли на капиллярной колонке размером 30 м, диаметром 0,25 мм и толщиной пленки 0,5 мм из 100% трифторпропилметилполисилоксана (Rtx-200).
Было оценено несколько температурных программ, и хроматограммы на рисунке 9 представляют результаты, полученные для всех образцов на этой неподвижной фазе.
На фигурах 9А и 9В производные PFPA и HFBA трех метоксибензоилпиперазинов сохраняются хуже, чем их региоизомерные метилендиоксибензилпиперазины.
Три бензоилпиперазина элюировались в порядке 2,3,4-метоксибензоилпиперазина.
Контролируемое вещество 3,4-МДБФ элюировалось последним во всех экспериментах в этой ограниченной серии соединений. Перфторацилированные производные не обеспечивали какой-либо дополнительной масс-спектральной дискриминации пяти изомеров.
Однако перфторацилирование обеспечило заметное улучшение хроматографического разрешения по сравнению с дериватизированными пиперазинами.
Заключение.
Три метоксибензоилпиперазина имеют косвенное региоизомерное родство с контролируемым веществом 3,4-МДБФ и его региоизомером 2,3-МДБФ. Пять региоизомерных пиперазинов дают очень похожие фрагментные ионы в своих масс-спектрах, причем только три региоизомера метоксибензоилпиперазина демонстрируют один уникальный основной фрагментный ион с m/z 152. Химическая дериватизация (перфторацилирование) не дала каких-либо дополнительных уникальных маркерных ионов, позволяющих идентифицировать одно соединение. в ущерб остальным.
Кроме того, точные измерения массы с помощью ГХ-ВП не обеспечили какого-либо различия между этими соединениями. ГХ-ИКД предоставил уникальные и характерные ИК-спектры, которые позволили различать эти соединения в диапазоне от 650 до 1700 см-1.
Кроме того, сильные карбонильные полосы поглощения четко отличают метоксибензоилпиперазины от метилендиоксибензилпиперазинов.
Пять производных PFPA и HFBA были успешно разрешены на стационарной фазе Rtx-200.
Разработанный препарат 3,4-метилендиоксибензилпиперазин (3,4-МДБФ), его позиционный изомер 2,3-метилендиоксибензилпиперазин (2,3-МДБФ) и три региоизомерных циклозамещенных метоксибензоилпиперазина (OMeBzPs) имеют идентичный элементный состав и не имеют заметных различий в их масс-спектры содержат только три региоизомера метоксибензоилпиперазина, показывающие один уникальный основной фрагментный ион с m/z 152.
Перфторацилирование вторичного аминного азота этих изомерных пиперазинов дало масс-спектры с различиями в относительном содержании некоторых фрагментных ионов, но не изменило фрагментацию. путь предоставления уникальных ионов для дискриминации этих изомеров.
Точное определение массы с использованием газовой хроматографии в сочетании с времяпролетной масс-спектрометрией (ГХ-ВП-МС) не позволило различить эти соединения, поскольку основные ионы-фрагменты имеют идентичный элементный состав.
Газовая хроматография в сочетании с инфракрасным обнаружением (GC-IRD) обеспечивает прямые подтверждающие данные для идентификации карбонилсодержащих соединений и дифференциации психоактивного дизайнерского препарата 3,4-MDBP от его прямого (2,3-MDBP) и непрямого (OMeBzPs) ) региоизомеры.
Масс-спектры в сочетании с инфракрасными спектрами паровой фазы обеспечивают конкретное подтверждение существования каждого из изомерных пиперазинов.
Нериватизированные и перфторацильные производные формы пяти пиперазинов, участвовавших в этом исследовании, были разделены на неподвижной фазе 100% трифторпропилметилполисилоксана (Rtx-200). Авторские права © 2011 John Wiley & Sons, Ltd.
Введение
Ряд производных пиперазина недавно появился на рынке запрещенных наркотиков и представляет собой новую группу дизайнерских наркотиков. Известно, что некоторые соединения типа 1-арилпиперазина обладают хорошим сродством к связыванию с серотониновыми рецепторами центральной нервной системы человека.
Это сродство становится более селективным с помощью соответствующих заместителей в ароматическом кольце.
Сообщается, что наиболее часто злоупотребляемыми соединениями этой группы являются N-бензилпиперазин и 3-трифторметилфенил пиперазин (3-TFMPP). И N-бензилпиперазин, и 3-TFMPP были внесены в Список 1 Закона США о контролируемых веществах в сентябре 2002 года.
Недавно было описано, что 3,4-метилендиоксибензилпиперазин (3,4-MDBP) оказывает психоактивное действие, подобное эффектам 3,4-метилендиоксибензилпиперазина (3,4-MDBP). ,4-метилендиоксиметамфетамин (МДМА).
Некоторые из этих соединений пиперазина коммерчески доступны и еще не находятся под особым юридическим контролем.
Сообщалось, что 3,4-метилендиоксибензилпиперазин (3,4-MDBP; пиперонилпиперазин) является потенциальным наркотиком, вызывающим злоупотребление, тогда как фармакология его 2,3-региоизомера еще не известна.
Действительно, анализ 3,4-MDBP в биологических и судебно-медицинских образцах был в центре внимания нескольких исследований в последние годы.
Недавний отчет показал, что 3,4-MDBP невозможно отличить от его 2,3-региоизомера с помощью масс-спектрометрии даже после химической дериватизации.
Однако газовая хроматография в сочетании с инфракрасным обнаружением (GC-IRD) позволила различить эти два соединения на основе различий в положении и интенсивности их ИК-полос пропускания.
В других отчетах описываются исследования с помощью ГХ-ИКД и газовой хроматографии-масс-спектрометрии (ГХ-МС) двух региоизомерных замещенных по кольцу метилендиоксибензилпиперазинов и их изобарных замещенных по кольцу метоксиметилбензилпиперазинов и этоксибензилпиперазинов, предлагающих методы распознавания между этими соединениями.
ГХ-МС является наиболее часто используемым методом анализа контролируемых веществ в судебно-медицинских лабораториях.
Идентификация психоактивных веществ по ряду химических категорий осложняется наличием региоизомерных и изобарных веществ, родственных целевому препарату.
Эти изомерные вещества представляют собой проблему для судебно-медицинского анализа, который должен во многом зависеть от масс-спектрометрии для получения данных об уровне подтверждения.
Эти региоизомерные и изобарные вещества имеют одинаковую номинальную массу и дают практически идентичные масс-спектры.
Предыдущие исследования показали, что методы химической дериватизации (в первую очередь перфторацилирования) могут успешно применяться для дискриминации многих изомерно родственных соединений.
Дериватизация может изменить основные пути фрагментации, часто предоставляя дополнительную структурную информацию об отдельном изомере, а также изменяя хроматографические свойства.
Однако в некоторых случаях дериватизация не дает характерных ионов масс-спектральных фрагментов для отдельных изомеров.
Инфракрасная спектроскопия считается методом подтверждения идентификации органических соединений из-за уникальности инфракрасных спектров очень похожих органических молекул.
ГХ-ИКД характеризуется достаточно быстрым сканированием для получения ИК-спектров паровой фазы соединений, элюируемых из капиллярной колонки ГХ.
Этот метод успешно использовался для идентификации изомеров амфетамина, а также региоизомеров боковой цепи, родственных метамфетамину и фентермину. Недавно были описаны исследования GC-IRD для дифференциации этоксифенэтиламинов с замещением по кольцу и боковой цепи, метоксиметкатинонов и метилендиоксиметамфетаминов.
Три замещенных по кольцу метоксибензоилпиперазина имеют непрямую региоизомерную связь с 2,3 и 3,4-МДБФ. Косвенные региоизомеры — это те, которые имеют одинаковую номинальную и точную массу, но имеют разное расположение атомов в своей химической структуре.
Замещение метоксигруппы в положениях 2, 3 и 4 ароматического кольца дает три возможных соединения бензоилпиперазина с замещением в кольце.
Метоксибензоил-(C8H7O2)-замещенные пиперазины имеют косвенное региоизомерное родство с метилендиоксибензил-замещенными пиперазинами.
Отсутствие аналитических эталонных стандартов для этих соединений затрудняет их идентификацию и распознавание в судебной химии наркотиков.
В этом отчете будут описаны исследования GC-IRD и GC-MS двух региоизомерных замещенных по кольцу метилендиоксибензилпиперазинов и их непрямых региоизомерных замещенных по кольцу метоксибензоилпиперазинов с целью предложить методы распознавания среди всех этих соединений.
Экспериментальный
Инструментарий
Анализ ГХ-МС проводился с использованием газового хроматографа 7890A с автоматическим инжектором 7683B, соединенным с масс-селективным детектором 5975 C VL, приобретенным у Agilent Technologies (Санта-Клара, Калифорния, США).
Скорость масс-спектрального сканирования составляла 2,86 скан/с. ГХ работал в режиме без деления потока со скоростью потока гелия (класс 5) 0,7 мл/мин и давлением в головке колонки 10 фунтов на квадратный дюйм.
МС работал в режиме электронного удара (ЭУ) с использованием напряжения ионизации 70 эВ и температуры источника 230°С. Инжектор ГХ поддерживался при 250°С, а линия переноса - при 280°С. Хроматографическое разделение осуществлялось с использованием капиллярная колонка длиной 30 м с внутренним диаметром 0,25 мм, покрытая 0,50 мм 100% трифторпропилметилполисилоксаном (Rtx-200).
Разделение пентафторпропионильных и гептафторбутирильных производных проведено.



Рисунок 1.
Масс-спектры дериватизированных метоксибензоилпиперазинов и метилендиоксибензилпиперазинов в данном исследовании.
проводили с использованием температурной программы, состоящей из начальной температуры 70°С в течение 1 минуты, постепенного повышения до 250°С со скоростью 30°С/мин с последующим выдерживанием при 250°С в течение 15 минут.
Анализ ГХ-ВП проводился в Центре масс-спектрометрии Обернского университета.
Для анализа использовали газовый хроматограф 6890N с автоматическим инжектором 7683B, приобретенным у Agilent Technologies (Санта-Клара, Калифорния, США), соединенный с Waters GCT.
Настольный времяпролетный масс-спектрометр с ортогональным ускорением Premier (oa-TOF).
Хроматографический анализ проводили с использованием капиллярной колонки длиной 30 м с внутренним диаметром 0,25 мм, покрытой пленкой неподвижной фазы толщиной 0,50 мм, колонки DB5-MS (J&W Scientific).
Температурная программа состояла из начальной температуры 70°С в течение 1 мин, постепенного повышения до 250°С со скоростью 15°С/мин с последующим выдерживанием при 250°С в течение 7 мин.
Идентификация была подтверждена анализом элементного состава с использованием точного измерения массы с внутренним калибрантом (lockmass 118,9919 m/z, гептакосафтортрибутиламин, Sigma) с допустимой погрешностью менее 5 ppm и изотопным моделированием, сравнивающим экспериментальное и теоретическое распределение изотопов.
Исследования ГХ-ИКД проводились с использованием газового хроматографа Hewlett-Packard 5890 Series II и автоинжектора Hewlett-Packard 7673, соединенного с инфракрасным детектором IRD-II (IRD-II), полученным от Analytical Solutions and Providers (ASAP), ( Ковингтон, Кентукки, США). Инфракрасные спектры паровой фазы записывались в диапазоне 4000–650 см-1 с разрешением 8 см-1 и скоростью сканирования 1,5 сканирований в секунду.
Температуру проточной ячейки IRD и линии передачи поддерживали на уровне 280°С, а ГХ работал в режиме без разделения со скоростью потока газа-носителя (гелий класса 5) 0,7 мл/мин и давлением в головке колонки 10 фунтов на квадратный дюйм.
Используемая капиллярная колонка представляла собой 30-метровую колонку с внутренним диаметром 0,25 мм, покрытую 0,50 мм смеси 50% фенил-50% метилполисилоксан (Rxi-50).
Температурная программа, использованная в этом исследовании, состояла из начальной температуры 70°С в течение 1 минуты, постепенного повышения до 230°С со скоростью 20°С в минуту с последующим выдерживанием при 230°С в течение 15 минут.
Капиллярная колонка, использованная в этих исследованиях, была приобретена у Restek Corporation (Беллефонте, Пенсильвания, США).
В анализах ГХ-МС и ГХ-ИКД образцы растворяли и разбавляли в ацетонитриле класса ВЭЖХ (Fisher Scientific, Фэрлон, Нью-Джерси, США) и вводили индивидуально или в физических смесях через автоматические инжекторы, используя объем впрыска 1 мл.
Лекарственные препараты и реагенты
Общая процедура синтеза двух региоизомерных бензилпиперазинов включает восстановительное аминирование соответствующим образом замещенного бензальдегида и пиперазина в присутствии цианборгидрида натрия.
Выделение основной фракции дало соответствующие бензилпиперазиновые основания, которые превратили в соответствующий гидрохлорид.

Рисунок 2.
Масс-спектральная картина фрагментации невариватизированного 3,4-метилендиоксибензилпиперазина в условиях ЭУ (70 эВ).

Рисунок 3.
Масс-спектральная картина фрагментации невариватизированных метоксибензоилпиперазинов в условиях ЭУ (70 эВ).
соли с использованием газообразной HCl и очищают перекристаллизацией.
Общая процедура синтеза трех региоизомерных метоксибензоилпиперазинов включает медленное добавление соответствующим образом замещенного бензоилхлорида к раствору пиперазина в дихлорметане на ледяной бане.
Выделение основной фракции дало соответствующие бензоилпиперазиновые основания, которые с помощью газообразной HCl переводили в соответствующие гидрохлоридные соли и очищали перекристаллизацией.
Исходными веществами для соединений 1, 2 и 3 являются 2, 3 и 4-метоксибензоилхлорид соответственно, а исходным веществом для соединения 5 является 3,4-метилендиоксибензальдегид (пиперональ), и все они коммерчески доступны. 2,3-метилендиоксибензальдегид является исходным материалом для 2,3-МДБФ (соединение 4), и о его получении сообщалось ранее.
Все лабораторные реагенты и растворители были получены от Aldrich Chemical Co. (Милуоки, Висконсин, США) или Fisher Scientific (Атланта, Джорджия, США). Реагенты для дериватизации трифторуксусный ангидрид (TFA), пентафторпропионовый ангидрид (PFPA) и гептафтормасляный ангидрид (HFBA) были приобретены у Sigma-Aldrich, Inc. (Милуоки, Висконсин, США).
Процедура дериватизации
Каждый перфторамид готовили индивидуально путем растворения примерно 0,3 мг (1,36 · 10–6 моль) каждой гидрохлоридной соли амина в 50 мл этилацетата с последующим добавлением большого избытка (250 мл) соответствующего дериватизирующего агента (ТФУ или ПФПА). или HFBA), и реакционные смеси инкубировали в пробирках с крышками при 70°С в течение 20 мин.
После инкубации каждый образец выпаривали досуха под током воздуха при 55°C и восстанавливали 200 мл этилацетата и 50 мл пиридина. Порцию каждого конечного раствора (50 мл) разбавляли ацетонитрилом для ВЭЖХ (200 мл) с получением рабочих растворов.
Результаты и обсуждение
Масс-спектральные исследования
Масс-спектрометрия является основным методом подтверждения идентичности наркотиков в пробах судебно-медицинской экспертизы. На рис. 1 показана масса ЭИ.

Рисунок 4.
Масс-спектральный анализ ГХ-ТОФ иона m/z 152 для 4-метоксибензоилпиперазина. (А) расчетная масса C8H10NO2; (B) экспериментальные результаты.

Рисунок 5.
Масс-спектр 4-метоксибензоил-d8-пиперазина.
спектры всех пяти изомерных пиперазинов (соединения 1–5).
Ионы значительного относительного содержания, общие для пяти изомеров, вероятно, возникают в результате фрагментации пиперазинового кольца.
Масс-спектры пяти пиперазинов содержат фрагментные ионы с m/z 178, 164, 135, 85 и 56, а также другие ионы с низким относительным содержанием.
Предлагаемые структуры этих фрагментных ионов показаны на рисунках 2 и 3 и основаны на предыдущем отчете, описывающем фрагментацию незамещенных бензилпиперазинов.
Региоизомерные метоксибензоильные фрагменты (C8H7O2)+ имеют те же номинальные и точные массы, что и метилендиоксибензильные катионы (C8H7O2)+, встречающиеся при m/z 135.
Масс-спектры циклозамещенных метоксибензоилпиперазинов (соединения 1–3) имеют практически идентичные масс-спектры с друг к другу и к изомерам метилендиоксибензилпиперазина



Рисунок 6.
Масс-спектры гептафторбутириловых производных трех метоксибензоилпиперазинов в этом исследовании.
(соединения 4 и 5), за исключением характерного высокого относительного содержания иона с m/z 152, который, по-видимому, специфичен для трех региоизомерных метоксибензоилпиперазинов.
Точный масс-анализ методом ГХ-ВП-МС подтвердил уникальный ион m/z 152 в региоизомерных бензоилпиперазинах (соединения 1–3) элементного состава C8H10NO2.
На рис. 4 показаны точные результаты измерения массы иона m/z 152 в 4-метоксибензоилпиперазине.
Верхняя панель (А) показывает ожидаемую/расчетную массу для элементного состава C8H10NO2, а нижняя панель (Б) показывает экспериментальные результаты вместе со степенью согласия (0,0 мДа, 0,0 ppm) между расчетными и экспериментальными результатами.
Предполагаемая структура иона m/z 152 C8H10NO2 показана на рисунке 4.
Предполагаемая структура этого фрагмента включает образование протонированного метоксибензамида.
Предложенная структура иона m/z 152 подтверждается масс-спектром октадейтромеченой формы 4-метоксибензоилпиперазина (4-метоксибензоил-d8-пиперазина).
Это меченное октадейтерием соединение было получено путем медленного добавления 4-метоксибензоилхлорида к раствору d8-пиперазина в дихлорметане на ледяной бане.
Масс-спектр меченной дейтерием формы соединения 3 показан на рисунке 5 и указывает на то, что два атома дейтерия остаются в составе рассматриваемого иона, поскольку в этом случае масса увеличилась на 2 Да до m/z 154.
Второй этап этого исследования включал получение и оценку перфторацильных производных изомерных пиперазинов с целью индивидуализации их масс-спектров и идентификации дополнительных уникальных ионов-маркеров для дифференциации между этими пятью соединениями. Ацилирование снижает основность азота и может позволить другим путям фрагментации играть более заметную роль в результирующих масс-спектрах.
Трифторацетильные, пентафторпропионильные и гептафторбутриловые производные вторичного азота оценивали на способность индивидуализировать масс-спектры этого ряда замещенных пиперазинов.
На рисунке 6 показаны масс-спектры гептафторбутриламидов трех метоксибензоилпиперазинов как представителей всех перфторацилированных пиперазинов, оцененных в этом исследовании.
Спектры производных ГФБА соединений 4 и 5 представлены ранее. Молекулярные ионы амидов TFA, PFPA и HFBA дают пики высокой относительной распространенности при m/z 316, 366 и 416 соответственно.
Основной фрагментный ион в этих спектрах находится при m/z 135 и соответствует замещенным в кольце бензильным или бензоильным катионам.
Кроме того, дополнительная серия фрагментных ионов, встречающаяся при m/z 181, 231 и 281 для амидов TFA, PFPA и HFBA соответственно, соответствует
Масс-спектральный анализ методом ГХ-ТОФ иона m/z 135 для 4-метоксибензоилпиперазина и 3,4-метилендиоксибензилпиперазина. (А) расчетная масса C8H7O2; (B) экспериментальные результаты. (C) расчетная масса C8H7O2; (D) результаты экспериментов.
Ион (М-135)+ для каждого амида. Эти ионы имеют более высокие относительные содержания в масс-спектрах производных метилендиоксибензилпиперазинов по сравнению с масс-спектрами метоксибензоилпиперазинов.
Ион с m/z 219 наблюдался в спектрах всех производных и, вероятно, образовался в результате отщепления перфторацильного фрагмента.
Ионы, встречающиеся при m/z 69, 119 и 169, представляют собой перфторалкильные катионы трифторметил, пентафторэтил или гептафторпропил из соответствующих амидов.
Эти исследования показывают, что химическая дериватизация (перфторацилирование) не дает каких-либо дополнительных уникальных маркерных ионов, позволяющих идентифицировать одно соединение при исключении других в этом наборе соединений.
Изомерные метоксибензоильные фрагменты (C8H7O2)+ имеют те же номинальные и точные массы, что и метилендиоксибензильный катион (C8H7O2)+, встречающийся при m/z 135. На рисунке 7 показан точный массовый анализ 4-метоксибензоила и 3, полученный методом ГХ-ТОФ-МС. 4-метилендиоксибензильный катион (m/z = 135) для соединений 3 и 5 соответственно. Верхняя панель (А) показывает ожидаемую/расчетную массу для элементного состава C8H7O2. На нижней панели (Б) показаны результаты эксперимента и степень согласия (-0,2 мДа) с расчетной массой.
Таким образом, подтверждая ион m/z 135 в соединении 3 как элементный состав C8H7O2.
Эти результаты можно сравнить с точным масс-анализом иона m/z 135 (3,4-метилендиоксибензильного катиона) в соединении 5. Рисунки 7C и 7D подтверждают элементный состав как C8H7O2 с отклонением массы 0,8 мДа.
Таким образом, точное измерение массы не различает эти косвенно региоизомерные формы иона (C8H7O2)+ m/z 135 и не дает каких-либо дискриминационных преимуществ перед обычным методом ГХ-МС.



Рисунок 8.
ИК-спектры паровой фазы пяти пиперазинов, участвовавших в этом исследовании.
Инфракрасная спектроскопия паровой фазы
Инфракрасная спектроскопия часто используется в качестве подтверждающего метода идентификации соединений при судебно-медицинской экспертизе наркотиков.
GC-IRD оценивали на предмет дифференциации пяти изомерных пиперазинов.
Инфракрасные спектры паровой фазы пяти пиперазинов показаны на фигуре 8 .
Спектры были получены в паровой фазе после введения образца в газовый хроматограф, и каждое соединение показывает полосы пропускания в областях 650–1700 см-1 и 2700–3100 см-1.
В целом изменения в характере замещения ароматического кольца приводят к изменениям в ИК-области от 650 до 1700 см-1.
Однако изменения в структуре боковой цепи часто приводят к изменениям в области 2700–1700 см-1.[23]
Поскольку пять пиперазинов имеют одинаковую степень замещения азота, т.е. одну и ту же боковую цепь, они имеют практически идентичные ИК-спектры в области 2700–3100 см-1.
Однако их легко отличить по положению и интенсивности нескольких ИК-пиков в области 650–1700 см-1.
Три региоизомерных метоксибензоилпиперазина имеют характерную сильную синглетную ИК-полосу при 1671 см-1, соответствующую растяжению карбонильной группы, которая позволяет отличить эти три бензоилпиперазина от двух метилендиоксибензилпиперазинов.
Три замещенных по кольцу бензоилпиперазина имеют почти одинаковые ИК-характеристики в области 2700–3100 см-1.
Однако их можно отличить по положению и интенсивности нескольких ИК-пиков в области 650–1700 см-1.
Соединение 3 демонстрирует сильный пик при 1246 см-1, который смещается к дублету средней интенсивности при 1289 см-1, 1242 см-1 в соединении 1 и сильному синглету при 1289 см-1 в соединении 2. Соединение 1 демонстрирует сильный пик. при 1420 см-1, который сдвинут к пику при 1408 см-1 как в соединениях 2, так и в 3. Соединение 3 также имеет пик средней интенсивности при 1003 см-1, который сдвинут к пику при 1015 см-1 в соединении 1 и слабый синглет при 1019 см-1 в соединении 2.
Региоизомер 2,3-МДБФ (соединение 4) характеризуется полосой средней интенсивности при 764 см-1, которая в региоизомере 3,4-МДБФ расщеплена на дублетные пики слабой и равной интенсивности при 760 и 810 см-1. (соединение 5).
Кроме того, в ИК-спектре 2,3-изомера наблюдаются другие слабые дублетные пики при 957 и 999 см-1, которые для 3,4-МДБФ смещены в синглет при 942 см-1.
Региоизомер 2,3-MDBP имеет относительно сильную ИК-полосу при 1069 см-1, которая у 3,4-региоизомера смещена к пику средней интенсивности при 1050 см-1.
ИК-спектр паровой фазы региоизомера 3,4-МДБФ можно отличить от спектра 2,3-региоизомера по крайней мере тремя ИК-полосами различной интенсивности.
Первым является пик сильной интенсивности при 1242 см-1 по сравнению с пиком промежуточной интенсивности при 1246 см-1 в 2,3-изомере. Второй представляет собой дублетный пик поглощения слабой интенсивности при 1331 и 1362 см-1, который проявляется как очень слабый дублет при 1297 и 1343 см-1 в 2,3-изомере.
Третий - сильный дублетный пик 3,4-МДБФ, появляющийся при 1443 и 1489 см-1.
Первое имеет почти половину интенсивности второго.
Это было эквивалентно появлению очень сильного синглета при 1459 см-1 в 2,3-региоизомере без эквивалентной полосы при 1443 см-1.

Рисунок 9.
Газохроматографическое разделение (A) пентафторпропионильных производных и (B) гептафторбутириловых производных пяти пиперазинов с использованием колонки Rtx-200.
Эти результаты служат прекрасной иллюстрацией ценности ИК-подтверждения паровой фазы региоизомерных веществ в этом исследовании. Полученные ИК-спектры показывают значительные различия в основных полосах этих пяти соединений.
Газовая хроматография.
Газохроматографическое разделение дериватизированных и дериватизированных пиперазинов осуществляли на капиллярной колонке размером 30 м, диаметром 0,25 мм и толщиной пленки 0,5 мм из 100% трифторпропилметилполисилоксана (Rtx-200).
Было оценено несколько температурных программ, и хроматограммы на рисунке 9 представляют результаты, полученные для всех образцов на этой неподвижной фазе.
На фигурах 9А и 9В производные PFPA и HFBA трех метоксибензоилпиперазинов сохраняются хуже, чем их региоизомерные метилендиоксибензилпиперазины.
Три бензоилпиперазина элюировались в порядке 2,3,4-метоксибензоилпиперазина.
Контролируемое вещество 3,4-МДБФ элюировалось последним во всех экспериментах в этой ограниченной серии соединений. Перфторацилированные производные не обеспечивали какой-либо дополнительной масс-спектральной дискриминации пяти изомеров.
Однако перфторацилирование обеспечило заметное улучшение хроматографического разрешения по сравнению с дериватизированными пиперазинами.
Заключение.
Три метоксибензоилпиперазина имеют косвенное региоизомерное родство с контролируемым веществом 3,4-МДБФ и его региоизомером 2,3-МДБФ. Пять региоизомерных пиперазинов дают очень похожие фрагментные ионы в своих масс-спектрах, причем только три региоизомера метоксибензоилпиперазина демонстрируют один уникальный основной фрагментный ион с m/z 152. Химическая дериватизация (перфторацилирование) не дала каких-либо дополнительных уникальных маркерных ионов, позволяющих идентифицировать одно соединение. в ущерб остальным.
Кроме того, точные измерения массы с помощью ГХ-ВП не обеспечили какого-либо различия между этими соединениями. ГХ-ИКД предоставил уникальные и характерные ИК-спектры, которые позволили различать эти соединения в диапазоне от 650 до 1700 см-1.
Кроме того, сильные карбонильные полосы поглощения четко отличают метоксибензоилпиперазины от метилендиоксибензилпиперазинов.
Пять производных PFPA и HFBA были успешно разрешены на стационарной фазе Rtx-200.
Вложения
