
Введение
В данном обзоре рассматриваются пути синтеза и фармакология синтетических каннабиноидных соединений. Синтетические каннабиноиды - это класс новых психоактивных веществ, которые действуют как агонисты каннабиноидных рецепторов. Этот класс соединений структурно разнообразен и быстро меняется, за последнее десятилетие было разработано несколько поколений молекул. Структурное разнообразие синтетических каннабиноидов поддерживается широтой химического пространства, доступного для эксплуатации подпольными химиками, и стимулируется попытками опередить правовое давление.
Что такое синтетические каннабиноиды
Каннабис содержит большое количество соединений, известных как "каннабиноиды". Они вырабатываются растением естественным образом, и самым важным из них является тетрагидроканнабинол, или ТГК. Это основное соединение в каннабисе, отвечающее за действие наркотика. Каннабиноиды в конопле воздействуют на каннабиноидные рецепторы, которые бывают двух видов - CB1 и CB2. Рецепторы CB1 находятся в основном в мозге, и именно взаимодействие каннабиноидов с этими рецепторами отвечает за психологические эффекты. Рецепторы CB2 находятся в основном в иммунной системе и частично отвечают за противовоспалительные и потенциальные лекарственные свойства каннабиса (хотя в некоторых случаях они также обусловлены взаимодействием с рецепторами CB1).
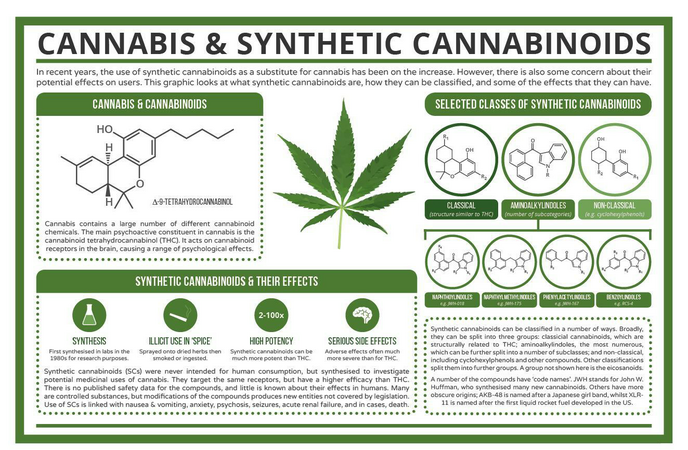
Почему у нас вообще есть рецепторы, которые химические вещества, содержащиеся в конопле, способны активировать? Каннабиноидные рецепторы обычно активируются так называемыми "эндогенными каннабиноидами" - другими словами, каннабиноидными химическими веществами, которые вырабатываются в нашем организме. Одним из них является анандамид, нейротрансмиттер, который выполняет ряд функций, включая боль, аппетит и память. Исследования роли эндогенных каннабиноидов все еще продолжаются - они были открыты только после изучения воздействия ТГК на организм, поэтому класс химических веществ и рецепторы названы в честь конопли.
Синтетические каннабиноиды - это класс соединений, изначально синтезированных для дальнейшего изучения каннабиноидных рецепторов и потенциальных медицинских преимуществ каннабиса. Ни один из них не встречается в каннабисе в естественном виде - все они являются продуктом лабораторного синтеза. Работа над ними началась в 1970-х годах, и первоначально они были структурно схожи с ТГК. Однако с тех пор было синтезировано множество соединений, структура которых значительно отличается от структуры ТГК. Общим для них является взаимодействие с каннабиноидными рецепторами.
Синтетические каннабиноиды можно группировать по-разному. Некоторые исследования относят их к трем очень широким категориям: классические каннабиноиды, которые структурно похожи на ТГК; аминоалкилиндолы, самая большая группа, которую можно разделить на дополнительные подкатегории; и неклассические каннабиноиды, которые включают такие соединения, как циклогексилфенолы. В других системах классификации используется семь или более групп, которые являются более структурно специфичными. Проблема с большим количеством новых и различных синтетических каннабиноидов, производимых как для исследований, так и для незаконного использования, заключается в том, что в некоторых случаях они не поддаются классификации в некоторых из этих систем, что привело некоторых исследователей к мысли о том, что вместо этого их следует классифицировать по биологической активности.
С точки зрения того, как они действуют, существуют незначительные различия между природными каннабиноидами, такими как ТГК, и синтетическими каннабиноидами. Хотя они действуют на одни и те же каннабиноидные рецепторы, ТГК является лишь частичным агонистом, в то время как синтетические каннабиноиды - полные агонисты. Эти термины потребуют небольшого пояснения для тех, кто с ними не знаком. Агонист - это молекула, которая связывается с рецептором и активирует его; однако частичный агонист не вызывает максимального ответа, в то время как полный агонист может это сделать. Тот факт, что синтетические каннабиноиды являются полными агонистами, означает, что их сила воздействия по сравнению с ТГК выше; исследования на животных показали, что их сила воздействия может быть в 2-100 раз выше, чем у ТГК.
Впервые о выделении синтетических каннабиноидов из "спайса" было сообщено в 2008 году, но сообщения об их использовании в "легальных наркотиках" появились раньше. Поскольку каннабис во многих странах классифицируется как запрещенный наркотик, синтетические каннабиноиды могут показаться привлекательной заменой для многих потенциальных курильщиков каннабиса. Сами синтетические каннабиноиды представляют собой твердые вещества, но их растворяют в растворителях, затем распыляют на высушенные травы, которые затем можно курить.
Пути синтеза
Большинство синтетических каннабиноидов синтезируются по общему принципу: ядро + связанная культура с линкером + хвост. Самый простой для понимания пример - синтез JWH-018: индол + 1-бензоилхлорид + 1-бромпентил. Ниже приведена схема синтеза с группами, которые выделены цветами.
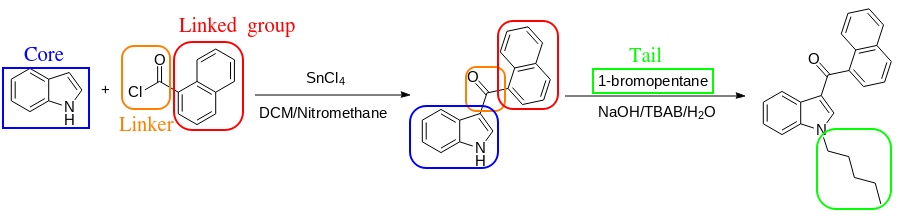
Достаточно простые пути синтеза позволяют создавать альтернативные синтетические каннабиноиды с определенным сродством к рецепторам CB1 (CB1R).
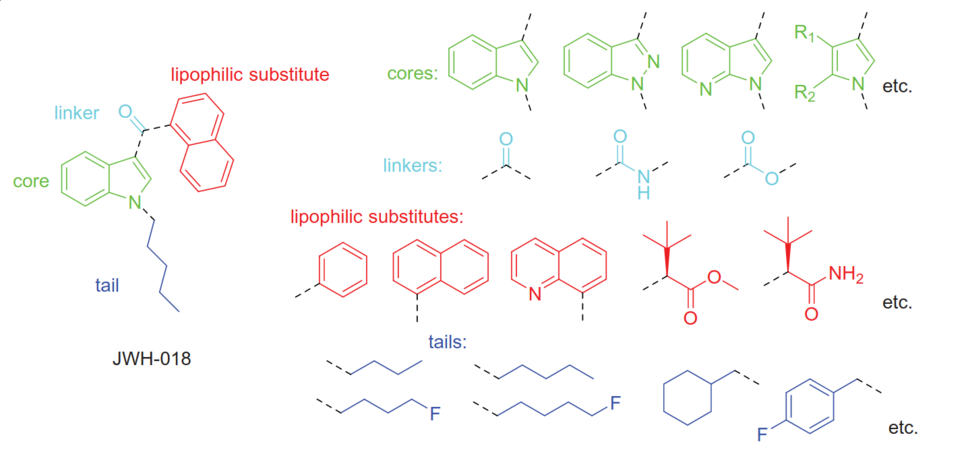
Общая структурная информация синтетических каннабиноидов на примере JWH-018, где пунктирные линии - соединенные связи.
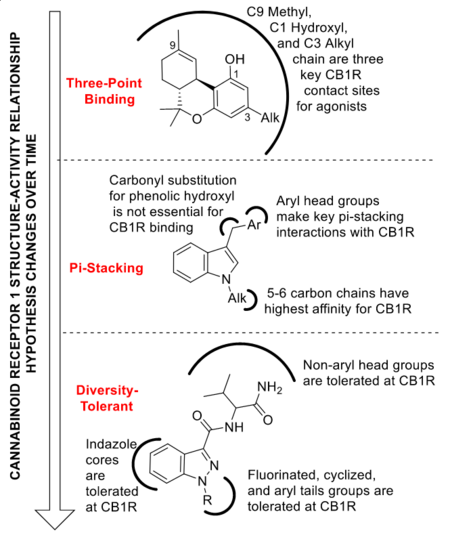
Самые ранние исследования взаимосвязи структуры и активности (SAR) известных лигандов CB1R, таких как ТГК, привели к гипотезе трехточечного связывания. Согласно этой гипотезе, связывание каннабиноидного рецептора зависело от трех структурных молекул ТГК: метильной группы C9, фенольного спирта и пентильной цепи, отходящей от C3. Эта модель связывания была поддержана ранним каннабимиметиком, WIN 55,212-2, аминоалкилиндолом, который связывается с CB1R и CB2R с высокой аффинностью, несмотря на то, что он структурно уникален по сравнению с ТГК. Таким образом, аминоалкилиндольный каркас оказался разумным шаблоном для ранних исследований SAR SCBs, и химики-исследователи начали создавать библиотеки для дальнейших лигандов каннабиноидных рецепторов на основе результатов, полученных с помощью этого первоначального каркаса. Одним из самых ранних исследований SAR связывания лигандов CB1R было усечение индольного ядра до пиррола. Хотя это изменение приводит к снижению активности на CB1R, оно все еще переносится. В соответствии с теорией трехточечного присоединения, считалось, что пентильная цепь C3, участвующая в сродстве ТГК к CB1R, имитируется в аминоалкилиндолах N-алкильной цепью. Были протестированы многие длины этой цепи, от метила до гептила, как в нафтоилиндолах, так и в пирролах, включая удаление аминогруппы, что не повлияло на сродство к CB1R. В то время как метилиндолы не проявляли сродства к CB1R, с этильной группой наблюдалось низкое микромолярное связывание. Эта тенденция увеличения активности продолжалась через н-гексил, где аффинность достигает 9,5 и 5,5 нМ для CB1R и CB2R, соответственно. Такая же тенденция наблюдается в соединениях с метильной группой, присутствующей в C2, хотя такие соединения демонстрируют пониженное сродство в целом. Аналогично, активность в отношении CB1R впервые наблюдалась только при использовании н-бутиловых расширений в пиррольных соединениях, достигая пика аффинности при включении н-пентильной группы.
Переходя к отдельной части этого алкилиндольного каркаса, были протестированы соединения с метокси-, алкил- и галогензамещенными вокруг нафтильного кольца. Эти аналоги привели к наблюдению, что добавки в стерически затрудненные позиции кольца не переносятся, в то время как группы, добавленные в свободно доступные позиции, переносятся, а иногда даже улучшают активность. Множественные ароматические стэкинг-взаимодействия также наблюдались in silico между высокоаффинными лигандами CB1R и трансмембранными доменами 3-6 CB1R, которые представляют собой область, богатую остатками тирозина, фенилаланина и триптофана. Более того, несколько соединений, использованных в этих исследованиях докинга, были аналогами JWH-серии, в которых специально отсутствовал карбонильный кислород, но при этом сохранялась активность CB1R, что опровергает главный постулат теории трех точек и поддерживает интерпретацию π-стекинга. Однако теория связывания агонистов CB1R с помощью π-стекинга, которая была достаточной для объяснения сродства нафтоилиндольных ССП, не смогла объяснить последующие поколения ССП. Среди них карбоксамиды, в которых нафтоильная группа заменена на неароматическое производное валина. Впоследствии было проведено множество SAR-исследований для определения влияния этих более широких изменений каркаса на сродство к CB1R, включая замену индольного ядра на близкородственный индазол, изменение боковой цепи валинамида, замену терминального карбоксамида на метиловый эфир и фторирование терминального конца N-алкильной цепи. В поддержку этого устойчивого к разнообразию SAR, на сегодняшний день существуют сотни известных соединений SCB, идентифицированных из изъятых продуктов, что позволило выявить десятки новых структурных изменений, которые не ухудшают активность CB1R, и одновременно их сложнее обнаружить. После такого расширения простое структурное обобщение SAR по всем известным ССП также стало намного сложнее. Тем не менее, на основе прототипических нафтоилиндольных ССП, общие структуры ССП можно разделить на четыре области: ядро, головка, линкер и хвост.
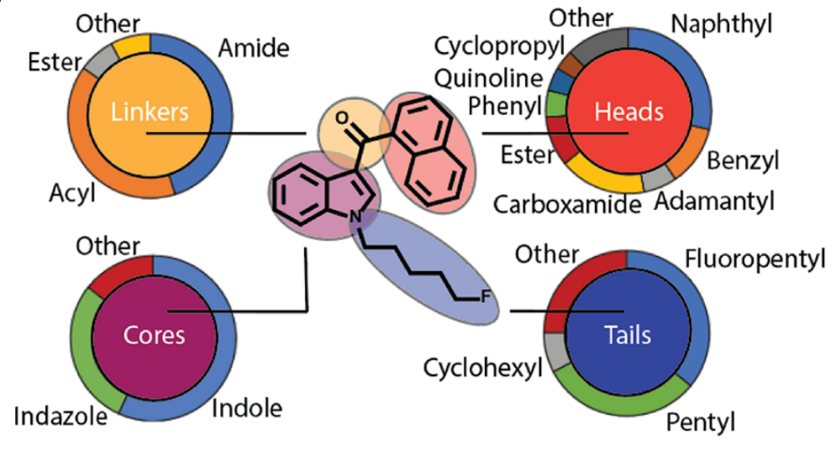
Большинство изъятых ССП в незаконных продуктах по-прежнему содержат индольные или индазольные ядра, а распространенные головные группы состоят из больших арилов, гидрофобных групп или производных валина. Эти две области чаще всего связаны ацильными, амидными или сложноэфирными связями. Большинство хвостовых групп представляют собой алкильные цепи, особенно пентильные разновидности и их терминально фторированные аналоги, хотя циклогексилметильные и бензильные хвостовые группы также заслуживают внимания. В целом, учитывая количество вариаций, наблюдаемых в пределах каждой области для этих известных ССП, можно представить от десятков до сотен тысяч различных комбинаторных молекул ССП, даже с учетом таких ограничений, как простота синтеза, стоимость прекурсоров и несовместимость различных соединений между четырьмя областями. Таким образом, для ССП остается огромное химическое пространство, которое вполне может быть использовано в подпольном производстве.
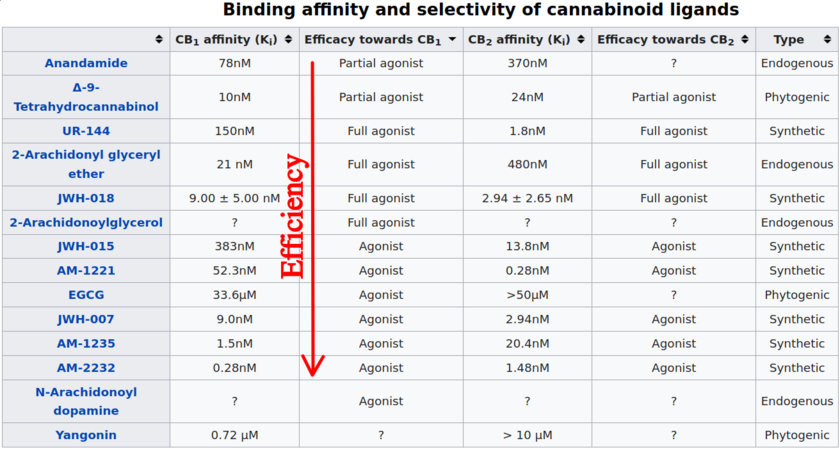
В связи с впечатляющим разнообразием молекул, обладающих агонистической активностью в отношении CB1R, существует несколько синтетических путей для создания ССП простым и экономически эффективным способом. Многие из наиболее распространенных маршрутов основаны на работе группы Джона Хаффмана по изучению CB1R SAR для нафтоил-индола и -пирролсодержащих соединений. Поскольку C3 является основным местом электрофильного замещения в индольном ядре, нафтоилиндолы были легко получены путем ацилирования по Фриделю-Крафтсу с последующим N-алкилированием. В отличие от этого, ацилирование пиррольного ядра происходит как по C2, так и по C3: для достижения селективности по C3 требуется добавление N-сульфонильной направляющей группы, а также изменение растворителя и температуры. Синтетическая сложность и пониженная активность CB1R пиррольных ССП обосновали приоритетность нафтоилиндольного скаффолда для будущего производства соединений. За прошедшие годы этот классический маршрут получил несколько вариантов получения 3-ацилиндольных ССП, таких как N-алкилирование перед 3-ацилированием и микроволновый синтез в режиме "one-pot". Поскольку многие СКБ нового поколения содержат амидные и сложноэфирные связи между основной и головной группами, для синтеза этих соединений требуются несколько иные подходы. Одним из самых простых методов получения этих ССП является N-алкилирование 1H-индола. Реакционная способность положения C3 индола позволяет добавлять трифторуксусный ангидрид к неочищенному N-алкилированному продукту. Полученный 1-алкил-3-трифторацетилиндол впоследствии гидролизуется до карбоновой кислоты. Затем эта кислота может быть превращена в хлорид кислоты или активирована стандартными реагентами сопряжения; при реакции с амином или спиртом образуются соответствующие индольные ССП, связанные амидом или эфиром, соответственно. В отличие от этого, амидные и сложноэфирные аналоги индазола, не обладающие реакционной способностью C3, требуют использования защищенной индазол-3-карбоновой кислоты, часто в виде метилового эфира. После N-алкилирования кислота может быть депротектирована, что позволяет соединять амины и спирты, как и раньше. Это несоответствие также объясняет относительное отсутствие ацилиндазольных ССП, которые были идентифицированы, поскольку ацилирование индазола по Фриделю-Крафтсу обычно не происходит на C3, что требует дополнительных модификаций и усложняет синтез.
Примеры:
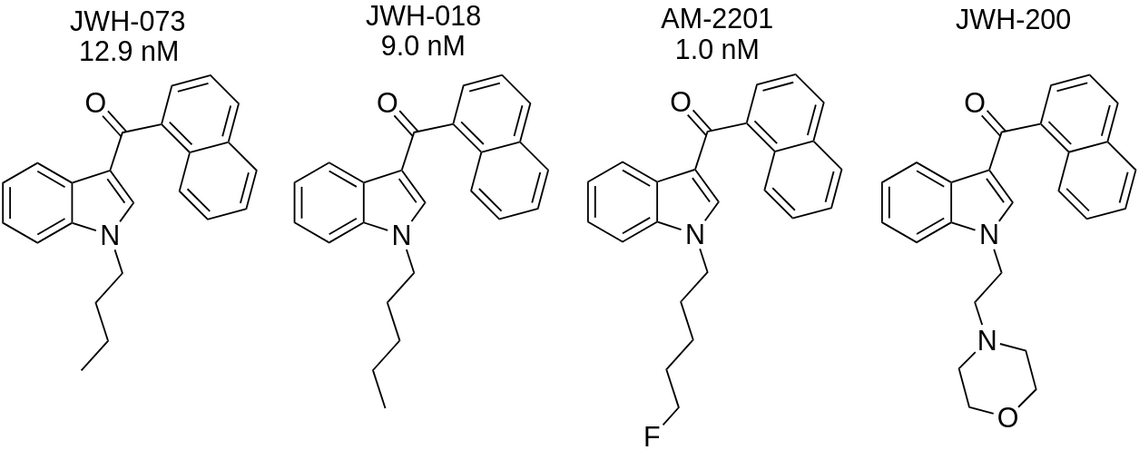
В качестве примеров различных синтетических каннабиноидов, которые синтезируются в соответствии с вышеописанными путями, могут быть представлены такие соединения, как JWH-073, JWH-018, AM-2201, JWH-200. Замены заместителей на индольном кольце (хвосты) были изменены в этом ряду, это изменяет их сродство к CB1R 12,9 ± 3,4 для JWH-073, 9,00 ± 5,00 нМ для JWH-018, 1,0 нМ для AM-2201 (с увеличением потенции).
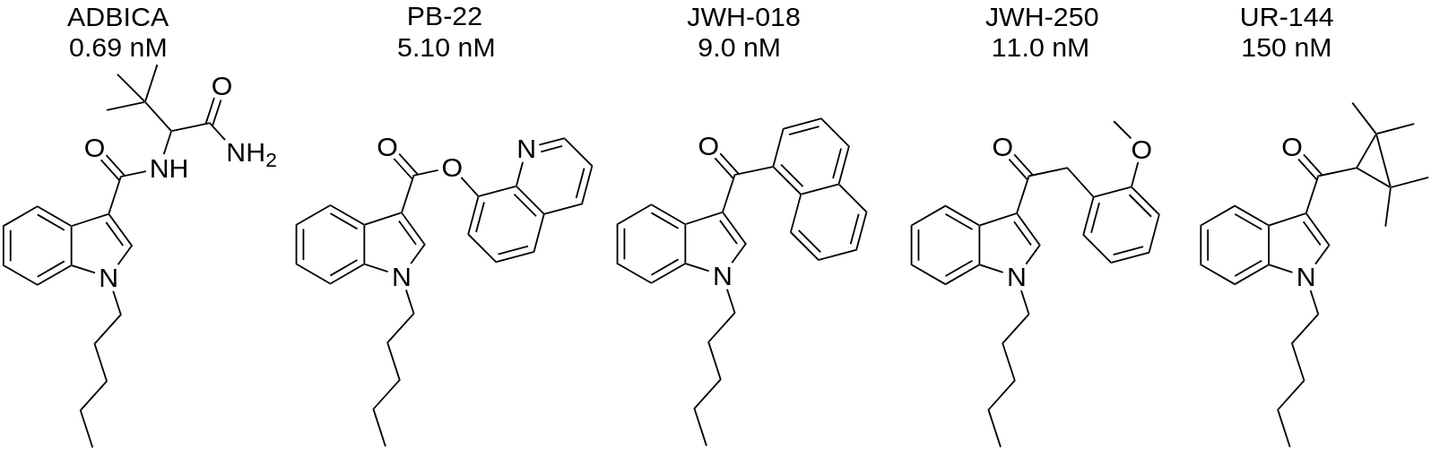
В ряду ADBICA, PB-22, JWH-018, JWH-250 и UR-144 заменены присоединенные группы (нафтильная группа JWH-018 на другие), это также изменяет их CB1R сродство 0,69 нМ для ADBICA, 5,1 нМ для PB-22, 9,00 ± 5,00 нМ для JWH-018, 11,00 нМ для JWH-250, 150 нМ для UR-144 (со снижением потенции).
Синтезы различных соединений происходят в одинаковых условиях с изменением реагентов и загрузок, что дает широкие возможности для химиков.
More Thread Same Category
- Способы курения гашиша для ньюфагов
- Рецепт твердой основы для синтетического гашиша
- Синтез JWH-018 с помощью реактива Гриньяра
- Готовые рецепты на ТВ, Россыпь и Мягкий
- Марихуанна - Marijuana
- Готовим канна-масло дома
- Секреты приготовления синтетического гашиша: проверенный рецепт
- Синтез CP-47,497 - синтетический гашиш
- Синтез ТГК - Тетрагидроканнабинол - обзор
- Синтез QUPIC (PB-22) синтетический гашиш
- Изомеризация каннабидиола (CBD) в психоактивные каннабиноиды
- Как приготовить качественный Микс (Спайс, Куреха, Дудка, Россыпь) от А до Я
- Синтез HU-210 - синтетический каннабиноид
- Синтез ТГК-О-ацетата из ТГК
- ADBICA также известный как ADB-PICA дизайнерский наркотик