Роль замещения галогена в классических каннабиноидах: мо-
дель фармакофора CB1
КРАТКАЯ АННОТАЦИЯ
Наличие галогенов в пределах классической структуры каннабиноида приводит к большим вариациям в активности соединений и химических связях с рецептором CB1. Чтобы исследовать зависимости структура-активность в пределах этого класса аналогов, мы использовали ряд галоген-замещённых аналогов (-)-Δ8 - тетрагидроканнабинола и сравнивали их химические связи с каннабиноидным рецептором CB1.
Наши результаты указывают, что галогенная замена в углеродном конце боковой цепи приводит к усилению в химической связи с более объёмными галогенами (Br, I) – что даёт наибольший эффект. Напротив, 2-йодо замена на фенольном кольце приводит к 2-кратному понижению химической связи, в то время как йодо-замена в C1'-позиции боковой цепи понижает химическую связь соединения с CB1 более, чем в 8 раз. Фармакофорные необходимые условия, происходящие из галоген-замещения, исследуются c использованием компьютерных методов моделирования.
ВВЕДЕНИЕ
Гашиш и его основной биоактивный компонент (-)-Δ9- тетрагидроканнабинол ((-)-Δ9-THC) так же как его изоактивный и более устойчивый изомер (-)-Δ8- тетрагидроканнабинол ((-)-Δ8-THC) в настоящее время получают внимание как потенциальные терапевтические компоненты. В течение прошедших 5 десятилетий было синтезировано и оценено на их биологическую активность много классических каннабиноидов, включая естественные компоненты гашиша, их метаболиты, и другие синтетические аналоги. Обзор существующей - литературы признал 4 фармакофора на трициклической терпеноидной структуры (Таблица 1), связанной с каннабинонэргической активностью: фенольный гидроксил в C1, боковая цепь длиной 5-8 атомов в C3, самый верхний алифатический гидроксил в C9 или C11, и самый нижний алифатический гидроксил.
Первые 2 входят в каннабиноиды растительного происхождения, в то время как все 4 фармакофора представлены в некоторых из синтетических неклассических каннабиноидов, разработанных Pfizer (Нью-Йорк, США), и пример их - CP- 55,940.6 Несмотря на широкую разновидность заместителей в различных фармакофорах на классической структуре THC, замещение галогена не получило большого внимания. Было синезировано небольшое количество галоидированных - каннабиноидов, включая 10 бромзамещённых каннабидиолов диацетат, 3-бром- тетрагидроканнабиоркол, 11-бром-Δ8- THC ацетат, и некоторые фторозамещённые - бромзамещённые - и йодо-замещённые каннабиноиды.
За исключением йодированных производных, которые были разработаны для пробирных радиоиммунологических анализов, эти галоидированные аналоги были получены в виде синтетических промежуточных звеньев и они не подвергались биологическому испытанию. Более того, сообщалось о некоторых Δ9- тетрагидроканнабинолах, несущих галогены в ароматическом кольце.
В течение ряда лет мы синтезировали несколько галоидированных аналогов, в качестве зондов для каннабинонэргических участков воздействия.
Например, (-)-5′-I-Δ8- THC (Таблица 1) использовался для изучения топографии каннабиноидов в мембранах, используя малоугловую рентгенографию, в то время как (-)-5'-[18F]-Δ8-THC синтезировался, как зонд визуализации позитронно-эмиссионной томография (ПЭТ) для экспериментов, направленных на изучение локализации каннабиноидных рецепторов в мозгу приматов. После испытания некоторых из галоидированных аналогов и в вытеснительном пробирном анализе и на животных моделях, мы обнаружили, что они обладали интересными профилями зависимости структура-активность (SAR). Эти данные обеспечили стимул для более систематического исследования связи структура-активность эффекта замещения галогена на основной структуре тетрагидроканнабинола. Об описании фармакологии "на живом организме" нескольких аналогов, приведённой здесь (Таблица 1), уже сообщалось в наших предварительных сообщениях. В данной работе, мы приводим синтетические процедуры для аналогов, описанных здесь, и расширяем наши исследования связи структура- активность, чтобы включать новые производные. Оценка химических связей этих галоидированных каннабиноидов позволила нам разработать подходящую модель фармакофора для рецептора CB1.
Таблица 1. Химические связи (Ki) аналогов тетрагидроканнабинола для каннабиноидных рецепторов CB1 (95%-ые доверительные пределы)
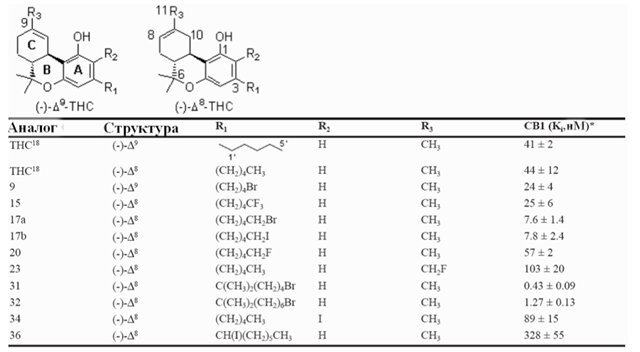
*Химические связи для CB1 определялись с использованием мембран мозга крысы (CB 1) [3H] CP-55,940 как меченого лиганда, следуя ранее описанным процедурам, значения Ki были получены из 3 независимых экспериментов, которые были проведены по 2 раза, и выражены как среднее из 3 значений.
МАТЕРИАЛЫ И МЕТОДЫ
Синтез
Коммерчески доступный 3,5-диметоксибензальдегид 1 послужил исходной точкой для синтеза (6aR-транс)-3-(4 бром-бутил)-6a,7,8,10a-тетрагидро-6,6,9-триметил-6H- дибензо[b,d]пиран-1-ол((-)-4'-бром-Δ9-тетрагидроканна- бинола) 9 путём последовательности реакций, изображённой на Схеме 1.
Таким образом, имеющийся в наличии (2-карбоксиэтил)трифенилфосфоний бромид был обработан бис(триметилсилил)амидом калия и произведённый фосфоран были соединён с 1, чтобы получить смесь изомеров 4-(3,5-диметилоксифенил)-3-бутеновую кислоту 2 с предпочтением транс изомера (транс:цис = 97:3 путём спектроскопии ядерного магнитного резонанса [1H ЯМР]) при 85%-ом выходе. Каталитическая гидрогенизация промежуточного алкена 2 привела к 4- (3,5-диметоксифенил)бутеновой кислоте 3 при 93%-ом выходе, которая была метилирована до соответствующего сложного метилового эфира 4 с использованием диазометана в количественном выходе.
Сокращение литий-алюминийгидрида у сложного эфира 4 позволило получить 4-(3,5-диметоксифенил)-1-бутанол 5 (98%-ый выход), который был преобразован в соответствующий бромид 6 путём обработки с трифенилфосфином и углеродистым четырёхбромистым соединением при 86%- ом выходе после очистки. Расщепление 2 фенольных групп метилового эфира выполнялось путём реакции трёхбромистого соединения бора в хлористом метилене, от чего получился 5-(4-бром-бутила)резорцина 7 при 97%-ом выходе. Это сопровождалось аллилированием Фриделя-Крафтса с (+)-цис/тран-p-мента-2,8-диен-1-ол в присутствии каталитического количества p-толуолсульфоновой кислоты, чтобы получилась производная каннабидиола 8 при 31%-ом выходе. Обработка 8 с эфиратом трёхфтористого бора при 0°C приводила к чистой реакции циклизации, что дало аналог Δ9-тетрагидроканнабинола 9 при 73%-ом выходе в чистом виде.
Синтез (6aR-транс)-3-(5,5,5-трифторо-пентил)-6a,7,10, 10a-тетрагидро-6,6,9-триметил-6H-дибензо[b,d]пиран-1- ол ((-)-5',5',5 '-трифторо-Δ8-тетрагидроканнабинол) 15 был выполнен последовательностью реакций, показанной на Схеме 2. 4-хлорбутановую кислоту обработали с четырёхфтористым соединением серы под давлением, и получившийся 1-хлор-4,4,4-трифторбутан 10 был соединён с трифенилфосфином, чтобы получился 1- трифенилфосфоний-4,4,4-трифторбутил хлорид 11 при 87%-ом выходе.
Реакция 11 с 3,5- диметоксибензальдегидом 1 в присутствии n-бутиллития дала 1:2 цис/транс-смесь аддукта Виттига 12 при 68%-ом выходе. Каталитическая гидрогенизация 12 привела к диметиловому эфиру резорцина 13 (92%-ый выход), который был преобразован деметилированием, используя трёхбромистое соединение бора в соответствующий резорцин 14 при 99%-ом выходе. Конденсация 14 с (+)- цис/транс-p-мента-2,8-диен-1-ол, катализируемого p- толуолсульфоновой кислотой, позволила получить ана- лог Δ8-тетрагидроканнабинола 15 при 68%-ом выходе.
(-)-5'-фтор-Δ8-тетрагидроканнабинол 20 был синтезирован из соответствующего исходного гидроксила 18 (Схема 3), который в свою очередь бвл получен из 4- феноксибутил бромида 16 в течение 7 этапов через 17a в соответствии с процедурой, описанной ранее.
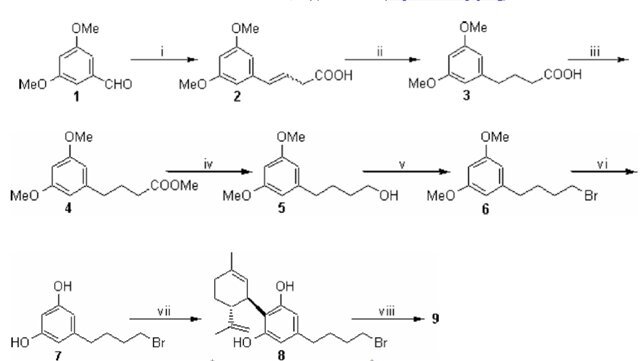
Схема 1. Реактивы и условия: (i) Br Ph3P+-(CH2) 2COOH, (Me3Si) 2N-K +, ТГФ, от 0°C до комнат. t°, 2 часа, 85 %; (ii) H2, 10%-ый Pd/C, AcOEt, в течение ночи, 93 %; (iii) CH2N2, Et2O, комнат. t°, количественный; (iv) LiAlH4, ТГФ, 0°C до комнатн t°, 2.5 часа, 98 %; (v) Ph3P, CBr4, CH2Cl2,-5°C, 15 минут, 86 %; (vi) BBr3, CH2Cl2,-10°C до комнатн. t°, 6 часов, 97 %; (vii) (+)-цис/транс-p-мента-2,8-диен-1-ол, p-TSA, CH2Cl2, 0°C, 1.5 часа, 31 %; (viii) BF3 · Et2O, CH2Cl2, 0°C, 40 минут, 73 %.
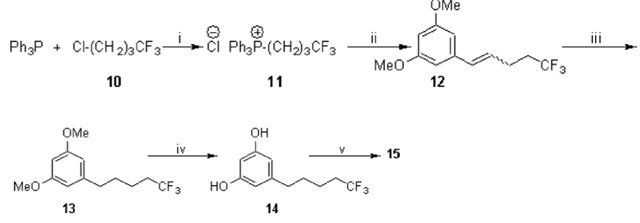
Схема 2. Реактивы и условия: (i) бензол, 110°C, 40 часов, 87 %; (ii) n-BuLi, 1, Et2O, рециркуляция, 3 часа, 68 %; (iii) H2, Pd/C (давление), EtOH, 8 часов, 92 %; (iv) BBr3, бензол, r t, 72 часа, 99 %; (v) (+)-цис/транс-p-мента-2,8-диен-1-ол, p-TSA, бензол, рециркуляция, 4 часа, 67 %.
Таким образом, (-)-5'-гидроксил-Δ8- тетрагидроканнабинол 18 был преобразован в трифлатный диэфир 19 (58%-ый выход) через реакцию с трифлатным ангидридом в присутствии с 2,6-лутидина. Из-за его тенденции к распаду, 19 был очищен колоночной флэш-хроматографией и непосредственно использовался в следующем этапе. Последовательное нуклеофильное замещение 5'-трифлатов фтористым ионом в присутствии криптофикса и сокращение фенольного трифлатного сложного эфира, с использованием литий-алюминийгидрида позволило получить 20 при 67%-ом выходе в чистом виде. (-)-5'-бром-Δ8- тетрагидроканнабинол 17a послужил также отправной точкой для синтеза (-)-5'-йодо-Δ8-тетрагидроканнабинола 17b путём следования описанной процедуре, и её модификации.
(-) -11-бром-Δ8-тетрагидроканнабинол ацетат 22 был ключевым промежуточным звеном в синтезе (-)-11-фтор- Δ8-тетрагидроканнабинол 23 (Схема4). Соединение 22 было подготовлено в 2 этапах, начиная с δ9 (-)-Δ9(11)- тетрагидроканнабинола 21 после процедуры , о которой сказано выше. Нуклеофильное замещение бромида 22, с использованием n-тетрабутиламмоний фторида, после чего следовал катализированный кислотой гидролиз фенольного ацетата, дали на выходе 23 при 30%-ом выходе в чистом виде.
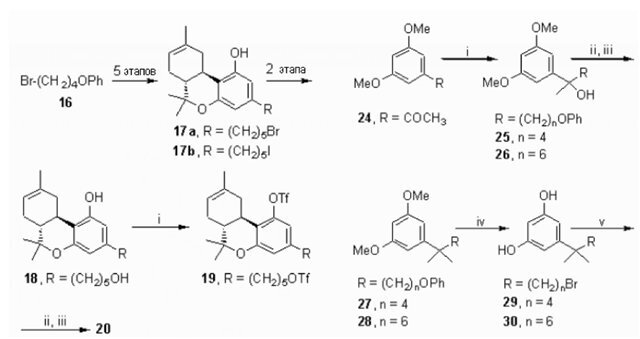
Схема 3. Реактивы и условия: (i) Tf2O, 2,6-лутидин, CH2Cl2, 0°C, 45 минут, 58 %; (ii) KF, криптофикс, CH3CN, 80°C, 40 минут; (iii) LiAlH4, Et2O, комн. t°, 15 минут, 67% от 19.
Реактивы и условия: (i) n-Bu4N + F-, ТГФ, 60°C, 1 час; (ii) 1N HCl, 30 % от 22.
Синтез (-)-5'-бром-1',1'-диметил-Δ - тетрагидроканнабинола 31 и (-)-7'-бром-1',1'- диметилгептил-Δ8-тетрагидро-каннабинола 32 показан на Схеме 5. Первый этап включает реакцию Гриньяра 3,5-диметоксиацетофенона 24 с 4- феноксибутилмагний бромидом или 6- феноксигексилмагний бромидом, чтобы получилось до настоящего времени неизвестные карбинолы 25 и 26 при 88%-ых и 90%-ых выходах, соответственно.
Схема 4. Реактивы и условия: (i) PhO (CH2) nMgBr, Et2O, рециркуляция, 1.5 часа, 88 % для n = 4, 90 % для n = 6; (ii) c. HCl, гексан, 40°C, 5 часов; (iii) Al (CH3) 3, 100°C, 96 часов, 51 % от 25 (n = 4), 40 % от 26 (n = 6); (iv) BBr3, бензол, комнатн. t°, 72 часа, 92 % для n = 4, 90 % для n = 6; (v) (+)-цис/транс-p- мента-2,8-диен-1-ол, p-TSA, бензол, рециркуляция, 4 часа, 57 % для n = 4, 65 % для n = 6.
Контакт 25 и 26 с сконцентрированной соляной кислотой, сопровождаемой триметилалюминием, дал на выходе соответствующие диметиловые эфиры резорцина 27 (51%-ый выход) и 28 (40%-ый выход). Надо подчеркнуть, что это преобразование сопровождается формированием некоторого алкена, побочного продукта элиминирования, при выходе от 17 % до 25%. Последующий контакт 27 и 28 с трёхбромистым соединением бора в хлористом метилене расщеплял все 3 простые эфирные группы и ввёл C5' и C7' бромзамещенную группу для 29 и 30 (90%-92% выход). Наконец, конденсация резорцинов 29 и 30 с (+)-цис/транс-p-мента-2,8-диен-1-ол в присутствии p-толуолсульфоновой кислоты дала на выходе (-)-Δ8-тетрагидроканнабиноловые аналоги 31 и 32 при выходах 57% и 65%, соответственно. После нашего предварительного сообщения был получен аналог 31, после чего шёл другой синтетический подход.
Реактивы и условия: (i) NaI, mCPBA, 18-крон-6, CH2Cl2, комнатн. t°, 30 минут, 54%.
Ранее описанный метод для получения галоидированных резорцинов был применён для синтеза (-)-2-йодо-Δ8 тетрагидроканнабинола 34. Этот метод включает в себя обработку (-)-Δ8-тетрагидроканнабинола 33 йодистым натрием и m-хлорпербензоевой кислотой в присутствии 18-крон-6 при комнатной температуре в течение 30 минут (Схема 6).
Мы выяснили, что эти условия были оптимальными для получения однойодистого продукта 34 при 54%-ом выходе. Часть 2,4-двуйодистого каннабиноида была также произведена при 7%-ом выходе, и этот процент мог быть увеличен, если бы реакции позволили продолжиться дальше.
Недавно мы описали эффективный синтез равномерно заполненной диастереоизомерной смеси (-)-1'- гидроксигептил-Δ8-тетрагидроканнабинола 35. Это соединение послужило исходным материалом для синтеза соответсвующего (-)-1'-йодо-гептил-Δ8- тетрагидроканнабинола 36, используя трифенилфосфин, йод,
Экспериментальная часть
Все реактивы и растворители были куплены у Aldrich Chemical Co (Милуоки, Висконсин) за исключением (+)- цис/транс-p-мента-2,8-диен-1-ол, который был предоставлен Firmenich Inc, Принстон, Нью-Джерси. Все безводные реакции выполнялись в статическом аргоне или атмосфере азота в просушенной пламенем стеклянной посуде, использующей тщательно просушенные растворители.
Органические фазы просушивались на MgSO4 и выпаривались при пониженном давлении. В колоночной флэш-хроматографии использовался силикагель 60 (ячей- ка 230-400). Все соединения были продемонстрированы на гомогенность аналитической тонкослойной хроматографией (тонкослойная хроматография) на предварительно покрытых планшетах тонкослойной хроматографии силикагеля (60 F245 на стекле, толщина слоя 250мкм, Merck, Whitehouse Station, Нью-Джерси), и хроматограммы визуализировались фосфорномолибденовым кислотным окрашиванием. Температуры плавления определялись на аппарате для определения точки плавления вещества и приведены в данной работе без исправлений. 1H спектры ядерного магнитного резонанса регистрировались на спектрометрe Bruker DMX-500 или Bruker AC-300 (Bruker BioSpin GmbH, Rheinstetten, Германия), или на IBM WP-200SY (IBM Corp, White plains, Нью-Йорк), функционирующем на 500, 300, и 200 МГц, соответственно. Все спектры ядерного магнитного резонанса регистрировались в CDCl3 если не заявлено иное, и о химических сдвигах сообщается в данной работе в единицах δ относительно внутреннего тетраметилсилана (TMS).
Мультиплетность указана как br (расширенный), s (синглет), d (сдвоенный пик), t (триплет), q (квартет), и m (мультиплет), а константы взаимодействия (J) указаны в Герц (Гц). Масс-спектры были получены в Корпорации Crompton (Middlebury, Коннектикут), с использованием гибридных тандемных масс-спектрометров Kratos MS 890 (Kratos Analytical Inc, Chestnut Ridge, Нью-Йорк). Масс- спектры с высоким разрешением были выполнены в Школе Химических Наук, Университета Иллинойса в Ur- bana-Campaign. Элементные анализы были получены, при использовании Perkin Elmer Elemental 2400 (Perkin Elmer, Wellesley, Массачусетс).
Реактивы и условия: (i) PPh3, I2, имидазол, толуол, комнатн. t°, 3 часа, 64 %.
4-(3,5-Диметоксифенил)-3-бутеновая кислота (2).
(2- Карбоксиэтил)трифенилфосфоний бромид был приготовлен согласно описанной процедуре, начиная с 3-бром- пропановой кислоты. К суспензии (2-карбоксиэтил) трифенилфосфоний бромид (40.3 г, 97.1 ммоль) в безводном тетрагидрофуране (ТГФ) (240 мл) при 0°C, в среде аргона, был добавлен калий бис(триметилсилил) амид (32.1 г, 161.3 ммоль). Смесь размешивалась в течение 45 минут, и раствор 3,5-диметоксибензальдегида 1 (5.37 г, 32.3 ммоль) в ТГФ (100 мл) добавлялся в течение 20 минут. После добавления реакция размешивалась ещё в течение 55 минут и затем погашалась посредством добаления 5%-ого водного HCl.
Смесь разбавлялось с AcOEt; органический слой был отделён; и водная фаза извлекалась с AcOEt. Комбинированный органический слой промывался с соляным раствором и просушивался на MgSO4; затем растворитель был выпарен при пониженном давлении. Остаток очищался колоночной флэш-хроматографией на силикагеле, используя 0.2 % метанола в этилацетате, чтобы получилась смесь изомеров (trans:cis = 97:3 1H ядерный магнитный резонанс) основного соединения 2 в виде светло-жёлтого тела при 85%-ом выходе (6.1 g). Т. пл. 50°C-53°C (Лит.21 Т. пл. 56°C- 64°C). 1H ядерный магнитный резонанс (CDCl3) транс- изомер, δ 6.53 (d, J = 2.2 Гц, 2H, ArH), 6.45 (d, J = 15.8 Гц, 1H, 4-H), 6.37 (t, J = 2.2 Гц, 1H, ArH), 6.27 (dt, J = 15.8 Гц, J =7.2Гц,1H,3-H),3.79(s,6H,OMe),3.29(dd,J=7.2Гц,J= 1.1 Гц, 2H, 2-H); цис-изомер, δ 5.86 (dt, J = 11.3 Гц, J = 7.4 Гц, 1H, 3-H).
4-(3,5-Диметоксифенил)-бутановая кислота (3).
К раствору 2 (5.58 г, 25.1 ммоль) в AcOEt (230 мл) было добавлено 10% Pd/C (0.95 g), и получившаяся суспензия размешивалась энергично в водородной среде и оставлена в течение ночи при комнатной температуре. Катализатор, отфильтрованный через целит и фильтрат, выпаривался при пониженном давлении, чтобы получить основное соединение 3 в виде белого тела при 93%-ом выходе (5.24 g). Т. пл. 63°C-65°C. (Лит. 27 Т. пл. 64°C-65°C); 1H ядерный магнитный резонанс (CDCl3) δ 6.34 (d, J = 1.7 Гц, 2H, ArH), 6.31 (t, J = 1.7 Гц, 1H, ArH), 3.78 (s, 6H, OMe), 2.62 (t, J = 7.5 Гц, 2H, 2-H), 2.38 (t, J = 7.4 Гц, 2H, 4-H), 1.95 (qt, J = 7.5 Гц, 2H, 3-H).
Метил 4-(3,5-диметоксифенил)бутират (4).
Раствор диазометана в диэтиловом эфире (~2.8 г в 100 мл) был приготовлен согласно процедуре, о которой сообщалось ранее, К раствору 3 (4.47 г, 20 ммоль) в Et2O (70 мл) добавлялся эфирный раствор диазометана (40 мл) при комнатной температуре. Выпаривание эфира дало основное соедиение 4 в виде светло-жёлтого масла при количественном выходе (4.74 g). 1H ядерный магнитный резонанс (CDCl3) δ 6.34 (d, J = 1.8 Гц, 2H, ArH), 6.31 (t, J = 1.8 Гц, 1H, ArH), 3.78 (s, 6H, OMe), 3.67 (s, 3H, COOMe), 2.59 (t,J=7.5Гц,2H),2.33(t,J=7.4Гц,2H),1.94(qt,J=7.5 Гц, 2H).
4-(3,5-Диметоксифенил)-1-бутанол (5).
К размешиваемой суспензии литий-алюминийгидрида (LAH) (2.1 г, 55.3 ммоль) в безводном ТГФ (150 мл) при 0°C в сре- де аргона добавлялся раствор 4 (4.4 г, 18.5 ммоль) в безводном ТГФ (35 мл) в течение 10 минут. Реагирующая смесь перемешивалась энергично в течение 2.5 часов при той же самой температуре и затем загашена, при добавлении NaF (2.33 г, 55.5 ммоль), после чего было добавление по каплям 10%-ого водного NaOH. Смесь нагревалась до комнатной температуры, разбавлялась этилацетатом и водой, и была профильтрована через целит. Органический слой был отделён, а водная фаза извлекалась дважды с этилацетатом. Комбинированный органический слой промывался с соляным раствором и просушивался на MgSO4; растворитель был выпарен при пониженном давлении. Очистка колоночной флэш- хроматографией на силикагеле (50%-ый этилацетат в гексане) дала на выходе основное соединение 5 в виде бесцветного масла при 98%-ом выходе (3.8 g). 1H ядер- ный магнитный резонанс (CDCl3) δ 6.35 (d, J = 2.1 Гц, 2H, ArH), 6.30 (t, J = 2.1 Гц, 1H, ArH), 3.78 (s, 6H, OMe), 3.65 (t, J = 6.1 Гц, 2H, 1-H), 2.59 (t, J = 7.2 Гц, 2H, 4-H), 1.79-1.54 (m, 4H, 2-H, 3-H).
4-(3,5-Диметоксифенил)-1-бром-бутан (6).
К размешиваемому раствору 5 (3.07 г, 14.6 ммоль) и углеродистому четырехбромистому соединению (7.27 г, 21.9 ммоль) в безводном CH2Cl2 (73 мл) при -5°C в среде аргона был добавлен трифенилфосфин (6.5 г, 24.8 ммоль) порциями. После того, как добавление было завершено, смесь размешивалась ещё в течение 15 минут, после чего растворитель был удален в вакууме. Остаток очищался очищался колоночной флэш-хроматографией на силикагеле, используя 15%-ый диэтиловый эфир в гексане, как в растворителе для элюирования, чтобы получить основное соединение 6 в виде светло-жёлтого масла (3.44 г, 86%-ый выход). 1H ядерный магнитный резонанс (CDCl3) δ 6.34 (d, J = 2.0 Гц, 2H, ArH), 6.30 (t, J = 2.0 Гц, 1H, ArH), 3.78 (s, 6H, OMe), 3.42 (t, J = 6.4 Гц, 2H, 1-H), 2.59 (t, J = 7.3 Гц, 2H, 4-H), 1.95-1.69 (m, 4H, 2-H, 3-H).
5-(4'-бром-бутил)резорцин (7).
К раствору 6 (3.16 г, 11.6 ммоль) в сухом CH2Cl2 (90 мл) при -5°C в среде аргона добавлялось трёхбромистое соединение бора (25.5 мл, раствор 1 М в CH2Cl2). После добавления температура реакции постепенно поднималась до комнатной температуры, и перемешивание было продолжено до завершения реакции (6 часов). Непрореагировавшее трёхбромистое соединение бора было нейтрализовано добавлением метанола и льда при 0°C. Получившаяся смесь нагревалась при комнатной температуре и размешивалась в течение 40 минут; летучие компоненты были удалены в вакууме. Остаток разбавлялся с EtOAc и промывался с насыщенным раствором NaHCO3, водой, и соляным раствором. Органический слой просушивался на MgSO4, фильтровался, и сгущался при пониженном давлении. Очистка колоночной флэш-хроматографией (40%-ый EtOAc в гексане) давала на выходе 2.75 г (97%-ый выход) соединения 7 в виде белого тела. Т. пл. 40°C-42°C; 1H ядерный магнитный резонанс (CDCl3) δ 6.25(d,J=2.1Гц,2H,4-H,6-H),6.19(t,J=2.1Гц,1H, 2-H), 4.89 (br s, 2H, О), 3.41 (t, J = 6.7 Гц, 2H, 4 '-H), 2.53 (t, J = 7.6 Гц, 2H, 1 '-H), 1.90-1.84 (m, 2H), 1.76-1.70 (m, 2H); отношение масса/заряд масс-спектра (относительная интенсивность) 247 (М. ++ 2, 17), 245 (М. +, 18), 195 (32), 135 (46), 119 (100). Точная масса (FAB) рассчитано для C10H14BrO2 (MH +), 245.0177; найдено, 245.0177.
(-)-2-[3-3,4-транс-p-ментадиен-(1,8)-ил]-5-(4'-бром- бутил)резорцин (8).
К раствору 7 (1.38 г, 5.63 ммоль) в CH2Cl2 (50 мл) при 0°C в среде аргона добавалялась p- толуолсульфоновая кислота (96 мг, 0.56 ммоль), после чего добавлялся раствор (+)-цис/транс-p-мента-2,8-диен- 1-ол (1.03 г, 6.76 ммоль) в CH2Cl2 (6 мл). Реагирующая смесь перемешивалась при 0°C в течение 1.5 часов, когда тонкослойная хроматография показала полный расход исходного материала. Реагирующая смесь была разбавлена с диэтиловым эфиром, и эфирный раствор промывался с насыщенным раствором NaHCO3, водой, и соляным раствором. Органический слой просушивался на MgSO4, фильтровался, и сгущался при пониженном давлении. Очистка колоночной флэш-хроматографией (17%-ый диэтиловый эфир в гексане) дала на выходе 660 мг (31%-ый выход) основного соединения 8 в виде светло-жёлтого вязкого масла. 1H ядерный магнитный резонанс (CDCl3) δ 6.27 (br s, 1H, ArH), 6.16 (br s, 1H, ArH), 6.00 (br s, 1H, О), 5.56 (s, 1H, 2-H), 4.68 (br s, 1H, О), 4.66 (s, 1H, 9-H), 4.55 (s, 1H, 9-H), 3.84 (m as br d, J = 8.7 Гц, 1H, 3-H), 3.40 (t, J = 6.7 Гц, 2H, 4 '-H), 2.48 (t, J = 7.5 Гц, 2H, 1 '-H), 2.39 (td, J = 11.0 Гц, J = 3.1 Гц, 1 H, 4- H), 2.27-2.20 (m, 1H), 2.13-2.07 (m, 1H), 1.88-1.76 (m, 7H, особенно 1.80, s, 7-CH33), 1.75-1.69 (m, 2H), 1.66 (s, 3H, 10-CH3); отношение масса/заряд масс-спектра (относи- тельная интенсивность) 380 (М. ++ 2, 15), 378 (М. +, 15), 312 (33), 310 (34), 299 (100), 297 (100), 215 (31), 121 (27). Точно вычисленная масса для C20H27BrO2, 378.1194; найдено, 378.1192
(-)-4'-бром-Δ9-тетрагидроканнабинол (9).
К размешиваемому раствору 8 (290 мг, 0.77 ммоль) в безводном CH2Cl2 (15 мл) при 0°C в среде аргона был добавлен эфират трехфтористого бора (0.24 мл 1.92 ммоль). Перемешивание продолжалось в течение 40 минут, и реакция была загашена посредством добаления насыщенного раствора NaHCO3. Органический слой был отделён, и водная фаза была извлечена с CH2Cl2. Комбинированный органический слой промывался с соляным раствором и просушивался на MgSO4; растворитель испарялся при пониженном давлении. Очистка колоночной флэш-хроматографией на силикагеле (25%-ый диэтиловый эфир в гексане) давала на выходе 213 мг (73%-ый выход) основного соединения 9 в виде смолы. 1H ядерный магнитный резонанс (CDCl3) δ 6.29 (br s, 1H, 10Н), 6.26 (s, 1H, 4-H), 6.14 (s, 1H, 2-H), 4.86 (br s,1H,О),3.40(t,J=6.4Гц,2H,4'-H),3.20(masbrd,J= 11.0 Гц, 1H, 10a-H), 2.48 (t, J = 7.1 Гц, 2H, 1'-H), 2.24-2.10 (m, 2H), 2.01-1.60 (m, 9H, особенно 1.68, s, C9-CH3), 1.53- 1.25 (m, 4H, особенно 1.41, s, 6α-CH3), 1.09 (s, 3H, 6α- CH3); отношение масса/заряд масс-спектра (относительная интенсивность) 380 (М++ 2, 68), 378 (М+, 69), 365 (50), 363 (51), 339 (27), 337 (27), 299 (69), 297 (100), 295 (96), 215 (33). Точно вычисленная масса для C20H27BrO2, 378.1194; найдено, 378.1199. Анализ вычислен: C, 63.33; H, 7.17. Найдено: C, 62.94; H, 7.26.
5-(3,5-Диметоксифенил)-1,1,1-трифторо-пентан (13).
1-хлор-4,4,4-трифторбутан 10 был приготовлен из соответствующей хлорбутановой кислоты и четырехфтористого соединения серы под давлением при 60°C, согласно описанной процедуре. Раствор трифенилфосфина (32 г, 122.9 ммоль) и 10 (12 г, 81.9 ммоль) в бензоле (20 мл) был помещён в герметезированный баллон, и нагревался до 110°C в течение 40 часов. Затем смесь охлаждалась до комнатной температуры, и растворитель был выпарен,
чтобы получить на выходе 29 г (87 %) 11 в виде белого тела (Т. пл. 168°C-170°C), которое использовалось в следующем этапе без дальнейшей очистки. К суспензии 11(23 г, 56.4 ммоль) в безводном Et2O (60 мл) при 0°C, в среде аргона, n-бутиллитий добавлялся по каплям -(раствор 24.8 мл, 62 ммоль, 2.5 М в гексане). Смесь красного цвета размешивалась в течение 30 минут, и раствор
3,5-диметоксибензальдегида 1 (14.1 г, 84.9 ммоль) в Et2O (75 мл) добавлялся в течение 10 минут. После добавления реагирующая смесь нагревалась с обратным холодильником в течение 2 часов, растворитель был выпарен, и полученный остаток был извлечён с нагреванием с обратным холодильником бензола. Концентрат очищался колоночной хроматографией, с использованием 10%-ного хлороформа в гексане в качестве растворителя для элюирования, чтобы получилось 10 г (68%-ый выход) 12 1:2 цис/транс-смеси. H ядерный магнитный резонанс (CDCl3) δ 6.45 (d, J = 12.0 Гц, 1H, 5-H), 6.38 (br s, 3H, ArH), 5.62-5.56 (m, 1H, 4-H), 3.78 (s, 6H, OMe), 2.65-2.54 (m, 2H, 2-H), 2.27-2.14 (m, 2H, 3-H).
Раствор 12 (9.3 г, 35.7 ммоль) в абсолютном EtOH и 10%-ый Pd/C (на 10 мл) (30 мг) был помещён в прибор Parr (Parr Instrument Co, Moline, Иллинойс) и обработан в течение ночи с водородом при 60 psi. Катализатор был отфильтрован через целит, и фильтрат был выпарен при пониженном давлении, чтобы получилось основное соединение 13 в виде светло- жёлтого масла при 92%-ом выходе (8.6 г). 1H ядерный магнитный резонанс (CDCl3) δ 6.31 (br s, 3H, ArH), 3.77 (s, 6H, OMe), 2.57 (t, J = 7.0 Гц, 2H, 5-H), 2.14-2.01 (m, 2H, 2-H), 1.96-1.53 (m, 4H, 3-H, 4-H). Анализ вычислен: C, 59.53; H, 6.53. Найдено: C, 59.79; H, 6.82.
5-(5', 5', 5 '-трифтор-пентил)резорцин (14).
Раствор трёхбромистого соединения бора (3.93 мл, 41.6 ммоль) в бензоле (20 мл) добавлялся по каплям к раствору 13 (8.4 г, 32 ммоль) в бензоле (80 мл), который был ранее охлаждён до 0°C. Реагирующая смесь перемешивалась при комнатной температуре в течение 72 часов. Реакция загашивалась осторожным добавлением воды со льдом, и органическая фракция была промыта с 5%-ым раствором сульфита натрия, соляного раствора, и воды. После высушивания растворитель был удалён и полученный остаток очищался колоночной хроматографией, с использованием 1%-ого метанола в хлороформе в качестве - растворителя для элюирования, чтобы получить 7.4 г (99%-ый выход) 14 в виде светло-коричневого вязкого масла. 1H ядерный магнитный резонанс (CDCl3) δ 6.24 (br s, 2H, 4-H, 6-H), 6.20 (br s, 1H, 2-H), 2.40 (t, J = 6.8 Гц, 2H, 1 '-H), 2.10-1.92 (m, 2H, 4 '-H), 1.52-1.50 (m, 4H, 2 '-H, 3 '-H). Анализ вычислен: C, 56.41; H, 5.59. Найдено: C, 56.74; H, 5.88.
(-)-5',5',5'-трифторо-Δ8-тетрагидроканнабинол (15).
Раствор 14 (4.06 г, 17.3 ммоль), (+)-цис/транс-p-мента-2,8- диен-1-ол (3.3 г, 21.7 ммоль) и p-толуолсульфоновая кислота (0.4 г, 2.32 ммоль) в бензоле (100 мл) был нагрет с обратным холодильником в течение 4 часов. Реакция была загашена с 5%-ым раствором кислого углекислого натрия, и органическая фракция была промыта с водой. После высыхания растворитель был удалён в вакууме, и полученный остаток очищался колоночной хроматографией, используя 10%-ый диэтиловый эфир в гексане как растворитель для элюирования, чтобы получилось 4.3 г (67%-ый выход) 15 в виде жёлтой смолы. 1H ядерный магнитный резонанс (CDCl3) δ 6.26 (s, 1H, 4-H), 6.10 (s, 1H, 2-H), 5.42 (br s, 1H, 8-H), 3.18 (dd, J = 16.0 Гц, J = 3.5 Гц,1H,10α-Н),2.70(td,J=10.3Гц,J=4.5Гц,1H,10a- H), 2.47 (t, J = 7.0 Гц, 2H, 1 '-H), 1.70 (s, 3H, C9-CH3), 1.38 (s, 3H, 6α-CH3), 1.10 (s, 3H, 6α-CH3); отношение масса/заряд масс-спектра 368 (М. Анализ вычислен: C, 68.46; H, 7.39. Найдено: C, 68.21; H, 7.58.
(-)-5 '-фтор-Δ8-тетрагидроканнабинол (20).
К раствору 18 10,12,24 (303 мг, 0.92 ммоль) и 2,6-лутидина (0.53 мл, 4.58 ммоль) в хлористом метилене (6 мл) охлаждённом до 0°C, добавлялся трифлатный ангидрид (0.68 мл, 4.06 ммоль), и смесь размешивалась в течение 45 минут. Затем растворитель был удалён, используя поток азота, и полученный остаток очищался колоночной флэш- хроматографией на флоризиле. используя 5%-й диэтиловый эфир в гексане, чтобы получилось 319 мг (58 %) довольно чистого (-)-5'-трифторометилсульфонилокси-Δ -тетрагидроканнабинол трифлата 19. 1H ядерный магнитный резонанс (CDCl3) δ 6.66 (s, 1H, 4-H), 6.60 (s, 1H, 2-H), 5.44 (br s, 1H, 8-H), 4.53 (t, J = 6.5 Гц, 2H, 5 '-H), 2.88 (m, 2H, 10α-Н, 10a-H), 2.56 (t, J = 7.0 Гц, 2H, 1 '-H), 1.70 (s, 3H, C9-CH3), 1.39 (s, 3H, 6α-CH3), 1.11 (s, 3H, 6α-CH3). Смесь 19 (319 мг, 0.54 ммоль), криптофикса (203 мг, 0.54 ммоль) и фтористого калия (44 мг, 0.76 ммоль) в ацетонитриле (5 мл) размешивалась при 80°C в течение 40 минут. Пока реагирующая смесь была все еще тёплой, растворитель был удален, используя поток азота. Полученный остаток был растворён в диэтиловом эфире (5 мл), раствор был охлажден до 0°C, и литий-алюминийгидрид (2 мл, раствор на 1М в Et2O) добавлялся по каплям. Смеси позволили достигнуть комнатной температуры и раз- мешивали в течении 30 минут. Затем она была охлаждена до 0°C, загашена добавлением этилацетата, и нейтрализо- вана с 1N HCl. После экстракции с Et2O органическая фракция просушивалась, растворитель удалён при по- ниженном давлении, и продукт очищался колоночной хроматографией (15%-ый диэтиловый эфир в гексане), чтобы получилось 120 мг (67%-ый выход) 20 в виде смо- лы.1Hядерныймагнитныйрезонанс(CDCl3) δ6.27(s,1H, 4-H), 6.10 (s, 1H, 2-H), 5.42 (br s, 1H, 8-H), 4.43 (dt, JH-F = 47.3 Гц, 2H, 5 '-H), 3.16 (dd, J = 16.1 Гц, J = 3.4 Гц, 1H, 10α-Н), 2.70 (td, J = 10.3 Гц, J = 4.5 Гц, 1 H, 10a-H), 2.46 (t, J = 7.0 Гц, 2H, 1 '-H), 1.69 (s, 3H, C9-CH3), 1.37 (s, 3H, 6α-CH3 ), 1.10 (s, 3H, 6α-CH3 ).
Анализ 75.87; H, 8.79. Найдено: C, 75.64; H, 9.05.
(-)-11-фтор-Δ -тетрагидроканнабинол (23).
Фторид n-тетробутиламмония в ТГФ (1М, 12 мл, 12 ммоль) был перемешан с (-)-11-бром-Δ8-тетрагидроканнабинол ацетатом 22 (536 мг, 1.23 ммоль), и получившийся раствор нагревалмя до 60°C в течение 45 минут. После охлаждения смесь была влита в раствор 1N HCl (30 мл) и экстрагирована с диэтиловым эфиром. Органическая фракция просушивалась, растворитель был удален при пониженном давлении, и полученный остаток очищался колоночной хроматографией, используя хлороформ в качестве растворителя для элюирования, чтобы получилось 122 мг (30%-ый выход) основного соединения в виде смолы. 1H ядерный магнитный резонанс (CDCl3) δ 6.28 (s, 1H, 4-H), 6.11 (s, 1H, 2-H), 5.85 (s, 1H, 8-H), 4.75 (d, JH-F = 48.0 Гц, 2H, 11-Н), 3.46 (dd, J = 16.0 Гц, J = 3.5 Гц, 1 H, 10α-Н), 2.73 (td, J = 10.3 Гц, J = 4.5 Гц, 1 H, 10a- H), 2.45 (t, J = 7.1 Гц, 2H, 1'-H), 1.40 (s, 3H, 6α-CH3), 1.12 (s, 3H, 6α-CH3 ), 0.85 (t, J = 7.0 Гц, 3H, 5 '-H); отно- шение масса/заряд масс-спектра 332 (М. +). Анализ вычис- лен: C, 75.87; H, 8.79. Найдено: C, 76.20; H, 8.97.
2-(3,5-Диметоксифенил)-6-феноксигексан-2-ол (25).
Несколько капель раствора 4-феноксибутил бромида (7.63 г, 33.3 ммоль) в диэтиловом эфире (70 мл) добав- лялись к шламообразной смеси диэтилового эфира (10 мл), охлаждённой до 0°C, содержащей магниевую стружку (0.94 г, 39 ммоль) и кристалл йода. Реакция началась с лёгким нагреванием с обратным холодильником, и остающйся бром добавлялся по каплям в течение 3 часов. Когда бóльшая часть магния была израсходовалана, реагирующая смесь была охлаждена до 0°C и по каплям добавлялся раствор 3,5-диметоксиацетофенон (5 г, 27.7 ммоль) в диэтиловом эфире (на 50 мл). Смесь нагревалась с обратным холодильником в течение 1.5 часов и затем размешивалась при комнатной температуре в течение ночи. После охлаждения до 0°C, реакция была загашена с 50%-ым раствором хлористого аммония. Затем смесь была экстрагирована с диэтиловым эфиром, и органическая фракция промывалась с водой и соляным раствором. После высыхания растворитель был выпарен, и полученный остаток очищался колоночной хроматографией, используя 20%-ый диэтиловый эфир в гексане в качестве растворителя для элюирования, чтобы получилось 8.1 г (88%-ый выход) 25 в виде масла. 1H ядерный магнитный резонанс (CDCl3) δ 7.30-6.91 (m, 5H, OPh), 6.59 (s, 2H, ArH), 6.35 (s, 1H, ArH), 3.93 (t, J = 6.2 Гц, 2H, 6-H), 3.79 (s, 6H, OMe), 1.54 (s, 3H, 1-H), 1.89- 1.17 (m, 6H, 3-H, 4-H, 5-H). Анализ вычислен: C, 72.70; H, 7.93. Найдено: C, 73.05; H, 8.14.
2-(3,5-Диметоксифенил)-8-феноксиоктан-2-ол (26).
Смесь 6-феноксигексил бромид29 (6.17 г, 24 ммоль) и магниевой стружки (0.68 г, 28 ммоль) в диэтиловом эфире (70 мл) была преобразована в 6- феноксигексилмагний бромид, который впоследствии обработали с раствором 3,5-диметоксиацетофенон (3.71 г, 10.6 ммоль) в диэтиловом эфире (40 мл) согласно процедуре, описанной для соединения 25. Очистка колоночная хроматографией (20%-ый диэтиловый эфир в гексане) дала на выходе 6.63 г (90%-ый выход) 26 в виде масла. 1H ядерный магнитный резонанс (CDCl3) δ 7.78-6.85 (m, 5H, OPh), 6.47 (s, 2H, ArH), 6.34 (s, 1H, ArH), 3.90 (t, J = 6.3 Гц, 2H, 8-H), 3.80 (s, 6H, OMe), 1.53 (s, 3H, 1-H), 1.86-1.17 (m, 10- ый, 3-H, 4-H, 5-H, 6-H, 7-H); отношение масса/заряд масс-спектра 358 (М+). Анализ вычислен: C, 73.71; H, 8.44. Найдено: C, 73.99; H, 8.62.
2-(3,5-Диметоксифенил)-2-метил-6-феноксигексан (27).
Смесь раствора 25 (3.05 г, 9.2 ммоль) в гексане (12 мл, также содержашем несколько капель диэтилового эфира, чтобы увеличить растворимость субстрата) и концентрированная HCl (10 мл) размешивалась энергично при 40°C в течение 5 часов. 2 слоя были отделены, и органическая фракция была промыта с водой, насыщенным раствором кислого углекислого натрия, и соляным раствором. Затем органическая фракция просушивалась и растворитель был удалён при пониженном давлении, чтобы получился 2-хлор- 2-(3,5-диметокси-фенил)-6-феноксигексан (3.09 g), который использовался без дальнейшей очистки. К раствору вышеупомянутого хлорида (3.09 g) в толуоле (10 мл), охлаждённом до 0°C, был добавлен раствор триметилалюминия в толуоле (2N, 18 мл, 35.8 ммоль). Получившаяся смесь нагревалась с обратным холодильником в течение 6 дней, охлаждалась до 0°C, и была нейтрализовала медленным добавлением концентрированной HCl. Органическая фракция была промыта с водой, насыщенным раствором кислого углекислого натрия, и соляным раствором. После высыхания растворитель был удалён при пониженном давлении, и полученный остаток очищался колоночной хроматографией (5%-ый диэтиловый эфир в гексане), чтобы получилось 1.553 г (выход на 51.4 %) 2713,20 в виде масла. 1H ядерный магнитный резонанс (CDCl3) δ 7.30-6.80 (m, 5H, OPh), 6.48 (s, 2H, ArH), 6.30 (s, 1H, ArH), 3.87 (t, J = 6.3 Гц, 2H, 6-H), 3.78 (s, 6H, OMe), 1.76-1.57 (m, 6H, 3-H, 4-H, 5-H), 1.27 (s, 6H, гем-CH3). Анализ вычислен: C, 76.79; H, 8.59. Найдено: C, 76.44; H, 8.72.
2-(3,5-Диметоксифенил)-2-метил-8-феноксиоктан (27)
Смесь 26 (7.0 г, 19.5 ммоль) и концентрированной HCl (20 мл) размешивалась энергично в течение 7 часов при 50°C. После экстракции с гексаном и промывания с водой, насыщенным бикарбонатом натрия и соляным раствором, был получен и использовался без дальнейшей очистки 2-хлор-2-(3,5-диметоксифенил)- 8-феноксиоктан (6.06 g).
Метилирование было проведено, следуя процедуре, описанной для 27, растворяя хлорид в толуоле (18 мл) и используя триметилалюминий (2N раствор в толуоле, 33 мл, 65 ммоль). Получившийся раствор нагревался до 100°C и размешивался в течение 5 дней. После отработки полученный остаток очищался колоночной хроматографией (5%- ый диэтиловый эфир в гексане), чтобы получилось 2.75 г (40%-ый выход) 28 в виде масла. 1H ядерный магнитный резонанс (CDCl3) δ 7.30-6.85 (m, 5H, OPh), 6.47 (s, 2H, ArH), 6.28 (s, 1H, ArH), 3.90 (t, J = 6.3 Гц, 2H, 8-H), 3.79 (s, 6H, OMe), 1.26 (s, 6H, гем-CH3), 1.75-1.07 (m, 10Н). Анализ вычислен: C, 77.49; H, 9.05. Найдено: C, 77.27; H, 8.74.
5-(5'-Бром-1',1'-диметилпентил)резорцин (29).
К раствору 27 (2.14 г, 6.52 ммоль) в бензоле (100 мл), охлаждённом до 0°C, медленно добавлялось трёхбромистое соединение бора (1.5 мл, 15.8 ммоль). Смесь размешивалась при комнатной температуре. В часовых интервалах 24 часа и 48 часов ещё добавлялось трёхбромистое со- единение бора (1 мл, 10.6 ммоль и 0.5 мл, 5.3 ммоль, соответственно). Реакции позволили продолжиться в течение в общей сложности 80 часов. Затем реагирующая смесь была загашена водой со льдом, и органическая фаза была промыта с 5%-ым раствором сульфита натрия и соляного раствора. После высыхания был удалён растворитель, и полученный остаток очищался колоночной хроматографией (20%-ый этилацетат в гексане), чтобы получилось 1.73 г (выход 92.5 %) 2913,20 в виде вязкого масла. 1H ядерный магнитный резонанс (CDCl3) δ 6.38 (d,J=1.9Гц,2H,4-H,6-H),6.25(t,J=1.9гц1H,2-H), 3.33 (t, J = 6.6 Гц, 2H, 5 '-H), 1.82-1.50 (m, 6H), 1.23 (s, 6H, гем-CH3). Анализ вычислен: C, 54.37; H, 6.67. Найдено: C, 54.14; H, 7.01.
5-(7'-Бром-1',1'-диметилгептил)резорцин (30).
Раствор 28 (2.75 г, 7.72 ммоль) в бензоле (30 мл) обрабатывался трёхбромистым соединением бора (1.5 мл, 15.8 ммоль) как описано для соединения 29. Ещё трехбромистое соединение бора добавлялось 24 часа и 48 часов спустя (1 мл, 10.6 ммоль и 0.5 мл, 5.3 ммоль, соответственно). Смесь размешивалась при комнатной температуре в течение в общей сложности 72 часов. Остаток, полученный после отработки, очищался колоночной хроматографией (25%-ый этилацетат в гексане), чтобы получилось 2.2 г (90%-ый выход) 30 в виде вязкого масла. 1H ядерный магнитный резонанс (CDCl3) δ 6.38 (d, J = 1.9 Гц, 2H, 4-H, 6-H), 6.17 (t, J = 1.9 Гц, 1H, 2-H), 3.38 (t, J = 6.7 Гц, 2H, 7 '-H), 1.25 (s, 6H, гем-CH3), 1.79-1.06 (m, 10Н); отношение масса/заряд масс-спектра 314 (М+). Анализ вычислен: C, 57.15; H, 7.35. Найдено: C, 57.27; H, 7.64.
(-)-5'-Бром-1',1'-диметил-Δ8-тетрагидроканнабинол (31).
Раствор 29 (3.28 г, 11.43 ммоль), (+)-цис/транс-p мента-2,8-диен-1-ол (2.19 г, 14.4 ммоль) и p-- толуолсульфоновой кислоты (0.41 г, 2.4 ммоль) в бензоле (90 мл) нагревался с обратным холодильником в течение 4 часов. После процедуры, описанной для аналога 15, полученный остаток очищался колоночной хроматографией (25%-ый диэтиловый эфир в гексане), чтобы получилось 2.74 г (57%-ый выход) 3113,20 в виде смолы. 1H ядерный магнитный резонанс (CDCl3) δ 6.37 (s, 1H, 4-H), 6.22 (s, 1H, 2-H), 5.43 (br s, 1H, 8-H), 3.33 (t, J = 6.6 Гц, 2H, 5 '-H), 3.22 (dd, J = 16.1 Гц, J = 3.4 Гц, 1H, 10α-Н), 2.69 (td, J = 10.3 Гц, J = 4.5 Гц, 1H, 10a-H), 1.70 (s, 3H, C9- CH3), 1.39 (s, 3H, 6α-CH3), 1.22 (s, 6H, гем-CH3), 1.11 (s, 3H, 6α-CH3); отношение масса/заряд масс-спектра 420 (М. +). Анализ вычислен: C, 65.55; H, 7.89. Найдено: C, 65.37;
(-)-7'-Бром-1',1'-диметилгептил-Δ -тетрагидроканна-бинол (32).
Следуя процедуре, описанной для соедине- ния 31, раствор 30 (2.5 г, 7.94 ммоль), (+)-цис/транс-p-мента-2,8-диен-1-ол (1.52 г, 9.93 ммоль) и p- толуолсульфоновая кислота (0.283 г, 1.647 ммоль) были нагреты с обратным холодильником в бензоле (100 мл) в течение 4 часов. Остаток, полученный после отработки, очищался колоночной хроматографией (10%-ый диэтиловый эфир в гексане), чтобы получилось 2.32 г (65%- ый выход) 32 в виде смолы. 1H ядерный магнитный резонанс (CDCl3) δ 6.37 (s, 1H, 4-H), 6.21 (s, 1H, 2-H), 5.42 (brs,1H,8-H),3.35(t,J=6.7Гц,2H,7'-H),3.19(dd,J= 16.0Гц,J=3.4Гц,1H,10α-Н),2.69(td,J=10.3Гц,J= 4.4 Гц, 1H, 10a-H), 1.69 (s, 3H, C9-CH3), 1.38 (s, 3H, 6α- CH3), 1.20 (s, 6H, гем-CH3), 1.11 (s, 3H, 6α-CH3); отноше- ние масса/заряд масс-спектра 448 (М. +). Анализ вычислен: C, 66.81; H, 8.30. Найдено: C, 66.56; H, 8.40.
(-)-2-Йодо-Δ8-тетрагидроканнабинол (34).
(-)-Δ8-тет- рагидроканнабинол 33 (500 мг, 1.59 ммоль) в хлористом метилене (2 мл), йодистый натрий (1.2 г, 8.0 ммоль) и 18- крон-6 (42 мг, 0.16 ммоль) были добавлены к раствору m-хлорпербензоевой кислоты (410 мг, 2.38 ммоль) в хлористом метилене (10 мл). Смесь размешивалась при комнатной температуре в течение 30 минут, была раз- бавлена с диэтиловым эфиром, и промывалась с 10%- ым раствором метабисульфита натрия. Органическая фракция была затем промыта с водой и просушивалась. Растворитель был выпарен, и полученный остаток очи- щался колоночной хроматографией, с использованием циклогексана в качестве растворителя для элюирования, чтобы получилось 380 мг (54%-ый выход) 34 в виде ко- ричневой смолы. 1H ядерный магнитный резонанс (CDCl3) δ 6.39 (s, 1H, 4-H), 5.42 (br s, 1H, 8-H), 3.24 (dd, J=16.0Гц,J=3.3Гц,1H,10α-Н),2.74(td,J=10.4Гц,J = 4.3 Гц, 1H, 10a-H), 2.59 (t, J = 7.0 Гц, 2H, 1 '-H), 1.70 (s, 3H, C9-CH3), 1.38 (s, 3H, 6α-CH3), 1.09 (s, 3H, 6α-CH3), 0.86 (t, J = 6.9 Гц, 3H, 5 '-H); отношение масса/заряд масс-спектра 440 (М. +). Анализ вычислен: C, 57.28; H, 6.64. Найдено: C, 57.59; H, 6.82.
(-)-1'-Йодо-гептил-Δ8-тетрагидроканнабинол (36).
Просушенная в печи, 5 мл, круглодонная колба была оборудована магнитной мешалкой, и была обеспечена среда аргона. В колбу был заряжен спирт 35 (30 мг, 0.09 ммоль), сухой толуол (0.2 мл), трифенилфосфин (44 мг, 0.17 ммоль), имидазол (17 мг, 0.26 ммоль), и йод (43 мг, 0.17 ммоль). Получившаяся смесь размешивалась энергично при комнатной температуре в течение 3 часов. После завершения, выпаривание растворителя и очистка колоночной флэш-хроматографией на силикагеле (5%-ый диэтиловый эфирный петролейный эфир) дали на выходе 25 мг (64%-ый выход) основного соединения 36 в виде вязкого масла. 1H ядерный магнитный резонанс (CDCl3) δ 6.46, 6.44, 6.31, 6.29 (s, 0.5Н каждый, смесь диастереоизомеров, ArH), 5.43 (d, J = 3.9 Гц, 1H, 8-H), 4.95-4.93 (m, 1H, смесь диастереоизомеров, 1′-CH- ),4.76(s,1H,О),3.18(dd,J=16.9Гц,J=4.0Гц,1H, 10α-Н), 2.67 (ddd как td, J = 10.6 Гц, J = 4.6 Гц, 1H, 10a- H), 2.26-2.16 (m, 3H, 7α-Н, 10β-Н, 7β-Н), 2.03-1.66 (m, 6H, 6a-Н, 2 '-CH2-, особенно 1.66, s, 9-CH3), 1.42-1.24 (m, 11H, 3 '-CH2-, 4 '-CH2-, 5 '-CH2-, 6 '-CH2-, 6α-CH3), 1.09 (s, 3H, 6α-CH3), 0.85, 0.83, (t, J = 7.1 Гц, 3H, смесь диастереоизомеров, 7 '-CH3).
Пробирный анализ cвязывания меченого лиганда
Были подготовлены синаптосомальные мембраны переднего мозга от замороженных мозгов крысы методом Dodd и др30 и они использовались, чтобы оценить химические связи аналогов каннабиноида с центром связывания CB1. Смещение специфично насыщенного тритием CP-55,940 от этих мембран использовалось, чтобы определить значения IC5 0 для испытываемого соединения. Пробирный анализ проводился на 96-луночном планшете микрофильтра. Образцы были профильтрованы, с использова- нием Packard Filtermate Harvester (Packard Instrument Co, Meriden, Коннектикут) и планшета Whatman GF/B (Whatman, Кент, Великобритания), альбумин из 0.5 % бычьей сыворотки (BSA) был включён в промывающий буфер. Радиоактивность обнаруживалась, используя коктейль сцинтилляции MicroScint 20 (Packard Instruments) который добавлялся к высушенным фильтровальным пластинам и подсчитывалась с применением Packard Instruments Top Count.
Данные были собраны от 3 независимых экспериментов между и специфическим связыванием 100% и 0 % для [3H]CP-55,940, определявшимся с использованием 0 и 100 нМ CP-55,940. Нормализованные данные от 3 независимых экспериментов были скомбинированы и проанализированы с использованием логистического уравнения с 4 параметрами, чтобы получить значения IC50, которые были преобразованы в значения Ki, используя допущения Cheng и Prussoff.
Молекулярное Моделирование
Вычислительные исследования выполнялись, используя программу Insight II/Discover на рабочей станции SGI Fuel (SGI, Mountain View, Калифорния). Каждый аналог сначала был создан с углами связи и длинами химической связи, дополненными функцией Builder feature (Строителя молекулы) и заданным полем сил CFF91. Затем использовались молекулярная механика и динамика, для исследования низкоэнергетических конформационных изомеров, был назначен интервал 1 фемтосекунды на каждое повторение. Сначала каждая структура была минимизирована, используя метод самого крутого спуска для 100 повторений, до тех пор, пока максимальная производная не станет меньше 0.1 ккал/моль. Затем, молекулярная динамика была инициализирована на 1000 повторений при 1000 K, чтобы уравновесить каждый аналог. После приведения в равновесие, процедура динамики была продолжена для 300 000 повторений при той же самой температуре чтобы взять полную выборку доступного конформационного пространства для каждого аналога. При 1000 итеративных интервалах атомные координаты регистрировались в файл архива в общей сложности для 300 конформаций на аналог. Вслед за этапом динамики, конформационные изомеры в каждом файле архива были подвергнуты минимизации, используя метод самого крутого спуска для 100 повторений, после чего шёл метод сопряжённого градиента для 5000 повторений, до тех пор, пока максимальное отклонение не стало менее 0.001 ккал/моль.
Значения двугранного угла (C2-C3-C1'-C2' и C3-C1'-C2'-C3') были получены из каждого конформационного изомера для анализа. Кроме того, контуры объёма боковой цепи каждого аналога рассчитывались с много- контурным модулем TRIPOS SYBYL34, для того, чтобы наблюдать за местом, занятым каждой боковой цепью.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Способности синтезируемых аналогов вытеснять меченный радиоактивным изотопом CP-55,940 из очищенных синаптосом переднего мозга крысы, определялись, как описано в разделе Методы и Материалы. Значения Ki, рассчитанные от соответствующих кривых замещения, перечислены в Таблице 1 и служат индикаторами для химических связей этих аналогов для рецепторов CB1.
Поверхностное изучение химических связей показывает некоторые интересные корреляции функции структуры, которые могут быть подытожены следующим образом:
• Замещение галогена в концевом атоме углерода боковой цепи приводит к усилению в химической связи лиганда для CB1 с большими галогенами, имеющими более высокие химические связи. Таким образом, для C1'-незамещённого ряда, где боковая цепь может быть представлена (CH ) R, порядок химических связей для различных заместителей R, следующий: CH2I = CH2Br> бром> CF3> CH3> CH2F. Этот порядок хорошо коррелируется с размером сегмента концевого атома углерода цепи, предполагая гидрофобное взаимодействие с соответствующим участком на рецепторе CB1.
Наши результаты показывают, что у аналогов 5'- йодопентил (17b) и 5'-бромпентил (17a) - самые высокие химические связи, в то время как у соединения с метиловыми группами ((-)-Δ8-THC) и фторметиловыми группами (20) – они самые низкие. Также, 4'-бром-аналог (9) взаимодействует более эффективно, чем исходное соединение (-)- Δ9-THC, отражая более крупный объём группы
брома по сравнению с метиловой группой.
• Введение 1',1′-диметилового заместителя усиливает взаимодействия галоидированной боковой цепи с CB1, как это наблюдается в 1',1 '-диметил- 5'-бромпентиловом (31) и 1',1'-диметил-7'- бромгептиловом (32) аналогах. У аналога пентила есть несколько более высокая химическая связь чем у соответствующего аналога гептила, можно предположить, что оптимальная длина цепи для боковой цепи ω-брома лежит в пределах длин цепи из 5 и 7 углеродов. Наличие 1',1'-диметиловой замены в цепи приводит к более чем 15-кратному увеличению химической связи. Это наблюдение является конгруэнтным с наличием гидрофобного подучастка в CB1, как было обсуждено в наших предыдущих публикациях26,36,37 Однако, ситуация очень отличается на 1'-йодо-аналоге (36), где наличие одной йодо-группы приводит к серьёзному уменьшению химической связи с рецептором CB1. Эта находка отражает либо неспособность подучастка CB1 разместить большую группу, такую как йодо-заместитель или наличие эффекта, который галоген может иметь на предпочтительной конформации боковой цепи.
• Введение фторозамещенной группы в 11-позицию (23) приводит к 2-кратному уменьшению связы- вающей способности.
• Введение 2-йодо заместителя (34) приводит к 2- кратному уменьшению химической связи. Этот результат может быть отнесён к пространственным эффектам, либо он связан с изменениями в конформации боковой цепи или с относительно малым неблагоприятным взаимодействием объёмистой йодо-группы с центром связывания CB1. Другой возможный неблагоприятный вклад 2-йодо группы – её электронное воздействие на группу фенольного гидроксила каннабиноидов.
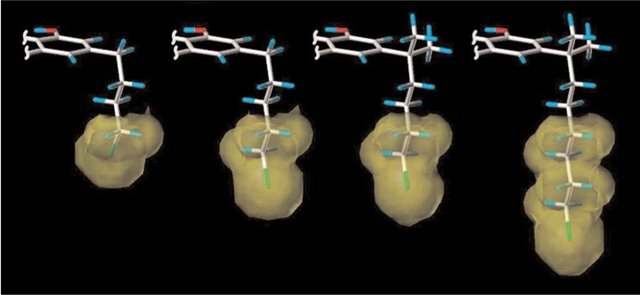
Рис. 1. Контуры объёма боковой цепи аналогов 9, 17a, 31, и 32 (слева направо). Здесь изображено только фенольное А кольцо каннабиноидов. Чтобы более эффективно представить фармакофорное место терминала боковой цепи, двугранный угол C2-C3- C1′-C2′ был зафиксирован на -120 градусах для показанных аналогов. Это значение представляет собой самые низкоэнергетиче- ские конформационные изомеры энергии для 31 и 32. Соответствующие конформационные изомеры для 9 и 17a представляют собой конформации только немногим более высокие, чем таковые с самой низкой энергией (ΔG = 1.13 ккал/моль). (Интерак- тивный вариант доступен в интернет-версии).
Вышеупомянутые данные дают интересные добавления в ныне доступную связь структура-активность для боковой цепи каннабиноида. Чтобы графически изобразить эти результаты, мы использовали вычислительные методы, которые позволили нам более точно определять стереоэлектронные необходимые условия этого фармакофора, Мы выполнили вычисления молекулярной механики и динамики на аналогах: 4'-бромбутил (9), 5'- бромпентил (17a), 1',1'-диметил-5'-бромпентил (31), 1',1'- диметил-7'-бромгептил (32), и 1'-йодогептил (36) и определили их соответствующие низкоэнергетические конформационные изомеры. Впоследствии, мы сосредоточились на C2-C3-C1'-C2' и C3-C1'-C2'-C3' – двугранных углах. Наши результаты показывают, что, за исключением аналога 1'-йодогептила (36), конформации боковых цепей показывают схожие предпочтения, которые могут использоваться как основание для объяснения различий в химическом связывании CB 1 для конформационных изомеров. Увеличенная химическая связь 17a против 9 является вероятно результатом увеличения длины боковой цепи от (CH2)4Br до (CH2)4CH2Br. Действительно, осмотр объёмов боковой цепи на Рис. 1 показывает более обширное место, занятое оконцовкой боковой цепи 17a. Это место может соответствовать гидрофобному региону в пределах связывающего кармана CB1, который будучи занятым, наделяет лиганд более высокой химической связью.
Этот гидрофобный регион вероятно является оптимальным для замещения концевого галогена на боковых цепях C5 или C6. Больший объём оконцовки боковой цепи C7 соединения 32 относительно 31 (Рис. 1) приводит к небольшому уменьшению связывающей способности CB1. Увеличенные химические связи всех C′-диметил замещённых аналогов, могут быть приписаны их взаимодействию с соответствующим подучастком в пределах центра связывания CB1, как обсуждено в наших предыдущих публикациях. Дополнительная причина для этих увеличенных химических связей может быть связана с предпочтительными конформациями этих лигандов вокруг связи C3-C1'. Как показано в Таблице 2, в отсутствие двух 1',1′-метиловых групп в 17a, двугранный угол C2-C3-C1'-C2' равен приблизительно ±90 градусам. Однако, во всех 1',1′-диметиловых аналогах, таких, как 31, значение этого двугранного угла близко к 60°, что может также соответствовать фармакофорной конфор- мации боковой цепи и привести к более высоким хими- ческим связям с CB1. Наконец, сравнение зеркальных изомеров R и S 1'-йодо аналога (36) показывает, что их значения двугранного угла, как ожидается, такие же по величине, но противоположные по знаку. Как было указано ранее, у 36 имеется слабая химическая связь с CB1, по сравнению с другими 4 аналогами. В то время, как на- личие C1' йода может вызвать некоторые неблагоприятные электростатические взаимодействия в пределах связывающего кармана CB1, его присутствие также даёт двугранный угол для C3-C1'-C2'-C3' ±165 градусов, значение, которое не присутствует ни в одном из конформационных изомеров других 4 аналогов (Рис 2). Возможно, эта конформация может препятствовать лиганду в уча- стии в благоприятном взаимодействии с CB1, таким образом приводя к относительно низкой химической связи для этого рецептора.
Таблица 2. Значения двугранного угла конформационного изомера для аналогов 9, 17a, 31, 32, и 36 (Зеркальные изомеры R и S) *

*Число в круглых скобках представляет число конформационных изомеров данного аналога, имеющего соответствующий двугранный угол.
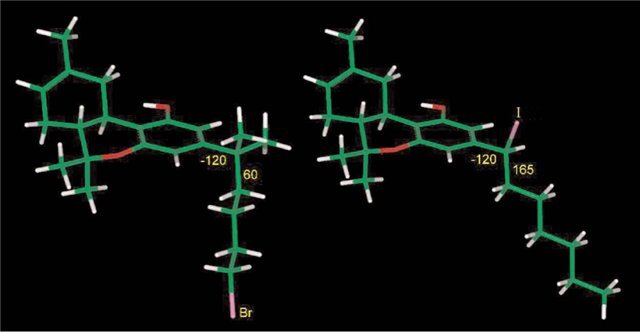
Рис 2. Низкоэнергетическая конформация аналога 31 (слева) по сравнению с зеркальным изомером S аналога 36. Величины двугранного угла C2-C3-C1′-C2′ и C3-C1′-C2′-C3′ показаны жёлтым. (Интерактивный вариант этого рисунка есть в Интернет- версии).
дель фармакофора CB1
КРАТКАЯ АННОТАЦИЯ
Наличие галогенов в пределах классической структуры каннабиноида приводит к большим вариациям в активности соединений и химических связях с рецептором CB1. Чтобы исследовать зависимости структура-активность в пределах этого класса аналогов, мы использовали ряд галоген-замещённых аналогов (-)-Δ8 - тетрагидроканнабинола и сравнивали их химические связи с каннабиноидным рецептором CB1.
Наши результаты указывают, что галогенная замена в углеродном конце боковой цепи приводит к усилению в химической связи с более объёмными галогенами (Br, I) – что даёт наибольший эффект. Напротив, 2-йодо замена на фенольном кольце приводит к 2-кратному понижению химической связи, в то время как йодо-замена в C1'-позиции боковой цепи понижает химическую связь соединения с CB1 более, чем в 8 раз. Фармакофорные необходимые условия, происходящие из галоген-замещения, исследуются c использованием компьютерных методов моделирования.
ВВЕДЕНИЕ
Гашиш и его основной биоактивный компонент (-)-Δ9- тетрагидроканнабинол ((-)-Δ9-THC) так же как его изоактивный и более устойчивый изомер (-)-Δ8- тетрагидроканнабинол ((-)-Δ8-THC) в настоящее время получают внимание как потенциальные терапевтические компоненты. В течение прошедших 5 десятилетий было синтезировано и оценено на их биологическую активность много классических каннабиноидов, включая естественные компоненты гашиша, их метаболиты, и другие синтетические аналоги. Обзор существующей - литературы признал 4 фармакофора на трициклической терпеноидной структуры (Таблица 1), связанной с каннабинонэргической активностью: фенольный гидроксил в C1, боковая цепь длиной 5-8 атомов в C3, самый верхний алифатический гидроксил в C9 или C11, и самый нижний алифатический гидроксил.
Первые 2 входят в каннабиноиды растительного происхождения, в то время как все 4 фармакофора представлены в некоторых из синтетических неклассических каннабиноидов, разработанных Pfizer (Нью-Йорк, США), и пример их - CP- 55,940.6 Несмотря на широкую разновидность заместителей в различных фармакофорах на классической структуре THC, замещение галогена не получило большого внимания. Было синезировано небольшое количество галоидированных - каннабиноидов, включая 10 бромзамещённых каннабидиолов диацетат, 3-бром- тетрагидроканнабиоркол, 11-бром-Δ8- THC ацетат, и некоторые фторозамещённые - бромзамещённые - и йодо-замещённые каннабиноиды.
За исключением йодированных производных, которые были разработаны для пробирных радиоиммунологических анализов, эти галоидированные аналоги были получены в виде синтетических промежуточных звеньев и они не подвергались биологическому испытанию. Более того, сообщалось о некоторых Δ9- тетрагидроканнабинолах, несущих галогены в ароматическом кольце.
В течение ряда лет мы синтезировали несколько галоидированных аналогов, в качестве зондов для каннабинонэргических участков воздействия.
Например, (-)-5′-I-Δ8- THC (Таблица 1) использовался для изучения топографии каннабиноидов в мембранах, используя малоугловую рентгенографию, в то время как (-)-5'-[18F]-Δ8-THC синтезировался, как зонд визуализации позитронно-эмиссионной томография (ПЭТ) для экспериментов, направленных на изучение локализации каннабиноидных рецепторов в мозгу приматов. После испытания некоторых из галоидированных аналогов и в вытеснительном пробирном анализе и на животных моделях, мы обнаружили, что они обладали интересными профилями зависимости структура-активность (SAR). Эти данные обеспечили стимул для более систематического исследования связи структура-активность эффекта замещения галогена на основной структуре тетрагидроканнабинола. Об описании фармакологии "на живом организме" нескольких аналогов, приведённой здесь (Таблица 1), уже сообщалось в наших предварительных сообщениях. В данной работе, мы приводим синтетические процедуры для аналогов, описанных здесь, и расширяем наши исследования связи структура- активность, чтобы включать новые производные. Оценка химических связей этих галоидированных каннабиноидов позволила нам разработать подходящую модель фармакофора для рецептора CB1.
Таблица 1. Химические связи (Ki) аналогов тетрагидроканнабинола для каннабиноидных рецепторов CB1 (95%-ые доверительные пределы)

*Химические связи для CB1 определялись с использованием мембран мозга крысы (CB 1) [3H] CP-55,940 как меченого лиганда, следуя ранее описанным процедурам, значения Ki были получены из 3 независимых экспериментов, которые были проведены по 2 раза, и выражены как среднее из 3 значений.
МАТЕРИАЛЫ И МЕТОДЫ
Синтез
Коммерчески доступный 3,5-диметоксибензальдегид 1 послужил исходной точкой для синтеза (6aR-транс)-3-(4 бром-бутил)-6a,7,8,10a-тетрагидро-6,6,9-триметил-6H- дибензо[b,d]пиран-1-ол((-)-4'-бром-Δ9-тетрагидроканна- бинола) 9 путём последовательности реакций, изображённой на Схеме 1.
Таким образом, имеющийся в наличии (2-карбоксиэтил)трифенилфосфоний бромид был обработан бис(триметилсилил)амидом калия и произведённый фосфоран были соединён с 1, чтобы получить смесь изомеров 4-(3,5-диметилоксифенил)-3-бутеновую кислоту 2 с предпочтением транс изомера (транс:цис = 97:3 путём спектроскопии ядерного магнитного резонанса [1H ЯМР]) при 85%-ом выходе. Каталитическая гидрогенизация промежуточного алкена 2 привела к 4- (3,5-диметоксифенил)бутеновой кислоте 3 при 93%-ом выходе, которая была метилирована до соответствующего сложного метилового эфира 4 с использованием диазометана в количественном выходе.
Сокращение литий-алюминийгидрида у сложного эфира 4 позволило получить 4-(3,5-диметоксифенил)-1-бутанол 5 (98%-ый выход), который был преобразован в соответствующий бромид 6 путём обработки с трифенилфосфином и углеродистым четырёхбромистым соединением при 86%- ом выходе после очистки. Расщепление 2 фенольных групп метилового эфира выполнялось путём реакции трёхбромистого соединения бора в хлористом метилене, от чего получился 5-(4-бром-бутила)резорцина 7 при 97%-ом выходе. Это сопровождалось аллилированием Фриделя-Крафтса с (+)-цис/тран-p-мента-2,8-диен-1-ол в присутствии каталитического количества p-толуолсульфоновой кислоты, чтобы получилась производная каннабидиола 8 при 31%-ом выходе. Обработка 8 с эфиратом трёхфтористого бора при 0°C приводила к чистой реакции циклизации, что дало аналог Δ9-тетрагидроканнабинола 9 при 73%-ом выходе в чистом виде.
Синтез (6aR-транс)-3-(5,5,5-трифторо-пентил)-6a,7,10, 10a-тетрагидро-6,6,9-триметил-6H-дибензо[b,d]пиран-1- ол ((-)-5',5',5 '-трифторо-Δ8-тетрагидроканнабинол) 15 был выполнен последовательностью реакций, показанной на Схеме 2. 4-хлорбутановую кислоту обработали с четырёхфтористым соединением серы под давлением, и получившийся 1-хлор-4,4,4-трифторбутан 10 был соединён с трифенилфосфином, чтобы получился 1- трифенилфосфоний-4,4,4-трифторбутил хлорид 11 при 87%-ом выходе.
Реакция 11 с 3,5- диметоксибензальдегидом 1 в присутствии n-бутиллития дала 1:2 цис/транс-смесь аддукта Виттига 12 при 68%-ом выходе. Каталитическая гидрогенизация 12 привела к диметиловому эфиру резорцина 13 (92%-ый выход), который был преобразован деметилированием, используя трёхбромистое соединение бора в соответствующий резорцин 14 при 99%-ом выходе. Конденсация 14 с (+)- цис/транс-p-мента-2,8-диен-1-ол, катализируемого p- толуолсульфоновой кислотой, позволила получить ана- лог Δ8-тетрагидроканнабинола 15 при 68%-ом выходе.
(-)-5'-фтор-Δ8-тетрагидроканнабинол 20 был синтезирован из соответствующего исходного гидроксила 18 (Схема 3), который в свою очередь бвл получен из 4- феноксибутил бромида 16 в течение 7 этапов через 17a в соответствии с процедурой, описанной ранее.

Схема 1. Реактивы и условия: (i) Br Ph3P+-(CH2) 2COOH, (Me3Si) 2N-K +, ТГФ, от 0°C до комнат. t°, 2 часа, 85 %; (ii) H2, 10%-ый Pd/C, AcOEt, в течение ночи, 93 %; (iii) CH2N2, Et2O, комнат. t°, количественный; (iv) LiAlH4, ТГФ, 0°C до комнатн t°, 2.5 часа, 98 %; (v) Ph3P, CBr4, CH2Cl2,-5°C, 15 минут, 86 %; (vi) BBr3, CH2Cl2,-10°C до комнатн. t°, 6 часов, 97 %; (vii) (+)-цис/транс-p-мента-2,8-диен-1-ол, p-TSA, CH2Cl2, 0°C, 1.5 часа, 31 %; (viii) BF3 · Et2O, CH2Cl2, 0°C, 40 минут, 73 %.

Схема 2. Реактивы и условия: (i) бензол, 110°C, 40 часов, 87 %; (ii) n-BuLi, 1, Et2O, рециркуляция, 3 часа, 68 %; (iii) H2, Pd/C (давление), EtOH, 8 часов, 92 %; (iv) BBr3, бензол, r t, 72 часа, 99 %; (v) (+)-цис/транс-p-мента-2,8-диен-1-ол, p-TSA, бензол, рециркуляция, 4 часа, 67 %.
Таким образом, (-)-5'-гидроксил-Δ8- тетрагидроканнабинол 18 был преобразован в трифлатный диэфир 19 (58%-ый выход) через реакцию с трифлатным ангидридом в присутствии с 2,6-лутидина. Из-за его тенденции к распаду, 19 был очищен колоночной флэш-хроматографией и непосредственно использовался в следующем этапе. Последовательное нуклеофильное замещение 5'-трифлатов фтористым ионом в присутствии криптофикса и сокращение фенольного трифлатного сложного эфира, с использованием литий-алюминийгидрида позволило получить 20 при 67%-ом выходе в чистом виде. (-)-5'-бром-Δ8- тетрагидроканнабинол 17a послужил также отправной точкой для синтеза (-)-5'-йодо-Δ8-тетрагидроканнабинола 17b путём следования описанной процедуре, и её модификации.
(-) -11-бром-Δ8-тетрагидроканнабинол ацетат 22 был ключевым промежуточным звеном в синтезе (-)-11-фтор- Δ8-тетрагидроканнабинол 23 (Схема4). Соединение 22 было подготовлено в 2 этапах, начиная с δ9 (-)-Δ9(11)- тетрагидроканнабинола 21 после процедуры , о которой сказано выше. Нуклеофильное замещение бромида 22, с использованием n-тетрабутиламмоний фторида, после чего следовал катализированный кислотой гидролиз фенольного ацетата, дали на выходе 23 при 30%-ом выходе в чистом виде.

Схема 3. Реактивы и условия: (i) Tf2O, 2,6-лутидин, CH2Cl2, 0°C, 45 минут, 58 %; (ii) KF, криптофикс, CH3CN, 80°C, 40 минут; (iii) LiAlH4, Et2O, комн. t°, 15 минут, 67% от 19.
Реактивы и условия: (i) n-Bu4N + F-, ТГФ, 60°C, 1 час; (ii) 1N HCl, 30 % от 22.
Синтез (-)-5'-бром-1',1'-диметил-Δ - тетрагидроканнабинола 31 и (-)-7'-бром-1',1'- диметилгептил-Δ8-тетрагидро-каннабинола 32 показан на Схеме 5. Первый этап включает реакцию Гриньяра 3,5-диметоксиацетофенона 24 с 4- феноксибутилмагний бромидом или 6- феноксигексилмагний бромидом, чтобы получилось до настоящего времени неизвестные карбинолы 25 и 26 при 88%-ых и 90%-ых выходах, соответственно.

Схема 4. Реактивы и условия: (i) PhO (CH2) nMgBr, Et2O, рециркуляция, 1.5 часа, 88 % для n = 4, 90 % для n = 6; (ii) c. HCl, гексан, 40°C, 5 часов; (iii) Al (CH3) 3, 100°C, 96 часов, 51 % от 25 (n = 4), 40 % от 26 (n = 6); (iv) BBr3, бензол, комнатн. t°, 72 часа, 92 % для n = 4, 90 % для n = 6; (v) (+)-цис/транс-p- мента-2,8-диен-1-ол, p-TSA, бензол, рециркуляция, 4 часа, 57 % для n = 4, 65 % для n = 6.
Контакт 25 и 26 с сконцентрированной соляной кислотой, сопровождаемой триметилалюминием, дал на выходе соответствующие диметиловые эфиры резорцина 27 (51%-ый выход) и 28 (40%-ый выход). Надо подчеркнуть, что это преобразование сопровождается формированием некоторого алкена, побочного продукта элиминирования, при выходе от 17 % до 25%. Последующий контакт 27 и 28 с трёхбромистым соединением бора в хлористом метилене расщеплял все 3 простые эфирные группы и ввёл C5' и C7' бромзамещенную группу для 29 и 30 (90%-92% выход). Наконец, конденсация резорцинов 29 и 30 с (+)-цис/транс-p-мента-2,8-диен-1-ол в присутствии p-толуолсульфоновой кислоты дала на выходе (-)-Δ8-тетрагидроканнабиноловые аналоги 31 и 32 при выходах 57% и 65%, соответственно. После нашего предварительного сообщения был получен аналог 31, после чего шёл другой синтетический подход.
Реактивы и условия: (i) NaI, mCPBA, 18-крон-6, CH2Cl2, комнатн. t°, 30 минут, 54%.
Ранее описанный метод для получения галоидированных резорцинов был применён для синтеза (-)-2-йодо-Δ8 тетрагидроканнабинола 34. Этот метод включает в себя обработку (-)-Δ8-тетрагидроканнабинола 33 йодистым натрием и m-хлорпербензоевой кислотой в присутствии 18-крон-6 при комнатной температуре в течение 30 минут (Схема 6).
Мы выяснили, что эти условия были оптимальными для получения однойодистого продукта 34 при 54%-ом выходе. Часть 2,4-двуйодистого каннабиноида была также произведена при 7%-ом выходе, и этот процент мог быть увеличен, если бы реакции позволили продолжиться дальше.
Недавно мы описали эффективный синтез равномерно заполненной диастереоизомерной смеси (-)-1'- гидроксигептил-Δ8-тетрагидроканнабинола 35. Это соединение послужило исходным материалом для синтеза соответсвующего (-)-1'-йодо-гептил-Δ8- тетрагидроканнабинола 36, используя трифенилфосфин, йод,
Экспериментальная часть
Все реактивы и растворители были куплены у Aldrich Chemical Co (Милуоки, Висконсин) за исключением (+)- цис/транс-p-мента-2,8-диен-1-ол, который был предоставлен Firmenich Inc, Принстон, Нью-Джерси. Все безводные реакции выполнялись в статическом аргоне или атмосфере азота в просушенной пламенем стеклянной посуде, использующей тщательно просушенные растворители.
Органические фазы просушивались на MgSO4 и выпаривались при пониженном давлении. В колоночной флэш-хроматографии использовался силикагель 60 (ячей- ка 230-400). Все соединения были продемонстрированы на гомогенность аналитической тонкослойной хроматографией (тонкослойная хроматография) на предварительно покрытых планшетах тонкослойной хроматографии силикагеля (60 F245 на стекле, толщина слоя 250мкм, Merck, Whitehouse Station, Нью-Джерси), и хроматограммы визуализировались фосфорномолибденовым кислотным окрашиванием. Температуры плавления определялись на аппарате для определения точки плавления вещества и приведены в данной работе без исправлений. 1H спектры ядерного магнитного резонанса регистрировались на спектрометрe Bruker DMX-500 или Bruker AC-300 (Bruker BioSpin GmbH, Rheinstetten, Германия), или на IBM WP-200SY (IBM Corp, White plains, Нью-Йорк), функционирующем на 500, 300, и 200 МГц, соответственно. Все спектры ядерного магнитного резонанса регистрировались в CDCl3 если не заявлено иное, и о химических сдвигах сообщается в данной работе в единицах δ относительно внутреннего тетраметилсилана (TMS).
Мультиплетность указана как br (расширенный), s (синглет), d (сдвоенный пик), t (триплет), q (квартет), и m (мультиплет), а константы взаимодействия (J) указаны в Герц (Гц). Масс-спектры были получены в Корпорации Crompton (Middlebury, Коннектикут), с использованием гибридных тандемных масс-спектрометров Kratos MS 890 (Kratos Analytical Inc, Chestnut Ridge, Нью-Йорк). Масс- спектры с высоким разрешением были выполнены в Школе Химических Наук, Университета Иллинойса в Ur- bana-Campaign. Элементные анализы были получены, при использовании Perkin Elmer Elemental 2400 (Perkin Elmer, Wellesley, Массачусетс).
Реактивы и условия: (i) PPh3, I2, имидазол, толуол, комнатн. t°, 3 часа, 64 %.
4-(3,5-Диметоксифенил)-3-бутеновая кислота (2).
(2- Карбоксиэтил)трифенилфосфоний бромид был приготовлен согласно описанной процедуре, начиная с 3-бром- пропановой кислоты. К суспензии (2-карбоксиэтил) трифенилфосфоний бромид (40.3 г, 97.1 ммоль) в безводном тетрагидрофуране (ТГФ) (240 мл) при 0°C, в среде аргона, был добавлен калий бис(триметилсилил) амид (32.1 г, 161.3 ммоль). Смесь размешивалась в течение 45 минут, и раствор 3,5-диметоксибензальдегида 1 (5.37 г, 32.3 ммоль) в ТГФ (100 мл) добавлялся в течение 20 минут. После добавления реакция размешивалась ещё в течение 55 минут и затем погашалась посредством добаления 5%-ого водного HCl.
Смесь разбавлялось с AcOEt; органический слой был отделён; и водная фаза извлекалась с AcOEt. Комбинированный органический слой промывался с соляным раствором и просушивался на MgSO4; затем растворитель был выпарен при пониженном давлении. Остаток очищался колоночной флэш-хроматографией на силикагеле, используя 0.2 % метанола в этилацетате, чтобы получилась смесь изомеров (trans:cis = 97:3 1H ядерный магнитный резонанс) основного соединения 2 в виде светло-жёлтого тела при 85%-ом выходе (6.1 g). Т. пл. 50°C-53°C (Лит.21 Т. пл. 56°C- 64°C). 1H ядерный магнитный резонанс (CDCl3) транс- изомер, δ 6.53 (d, J = 2.2 Гц, 2H, ArH), 6.45 (d, J = 15.8 Гц, 1H, 4-H), 6.37 (t, J = 2.2 Гц, 1H, ArH), 6.27 (dt, J = 15.8 Гц, J =7.2Гц,1H,3-H),3.79(s,6H,OMe),3.29(dd,J=7.2Гц,J= 1.1 Гц, 2H, 2-H); цис-изомер, δ 5.86 (dt, J = 11.3 Гц, J = 7.4 Гц, 1H, 3-H).
4-(3,5-Диметоксифенил)-бутановая кислота (3).
К раствору 2 (5.58 г, 25.1 ммоль) в AcOEt (230 мл) было добавлено 10% Pd/C (0.95 g), и получившаяся суспензия размешивалась энергично в водородной среде и оставлена в течение ночи при комнатной температуре. Катализатор, отфильтрованный через целит и фильтрат, выпаривался при пониженном давлении, чтобы получить основное соединение 3 в виде белого тела при 93%-ом выходе (5.24 g). Т. пл. 63°C-65°C. (Лит. 27 Т. пл. 64°C-65°C); 1H ядерный магнитный резонанс (CDCl3) δ 6.34 (d, J = 1.7 Гц, 2H, ArH), 6.31 (t, J = 1.7 Гц, 1H, ArH), 3.78 (s, 6H, OMe), 2.62 (t, J = 7.5 Гц, 2H, 2-H), 2.38 (t, J = 7.4 Гц, 2H, 4-H), 1.95 (qt, J = 7.5 Гц, 2H, 3-H).
Метил 4-(3,5-диметоксифенил)бутират (4).
Раствор диазометана в диэтиловом эфире (~2.8 г в 100 мл) был приготовлен согласно процедуре, о которой сообщалось ранее, К раствору 3 (4.47 г, 20 ммоль) в Et2O (70 мл) добавлялся эфирный раствор диазометана (40 мл) при комнатной температуре. Выпаривание эфира дало основное соедиение 4 в виде светло-жёлтого масла при количественном выходе (4.74 g). 1H ядерный магнитный резонанс (CDCl3) δ 6.34 (d, J = 1.8 Гц, 2H, ArH), 6.31 (t, J = 1.8 Гц, 1H, ArH), 3.78 (s, 6H, OMe), 3.67 (s, 3H, COOMe), 2.59 (t,J=7.5Гц,2H),2.33(t,J=7.4Гц,2H),1.94(qt,J=7.5 Гц, 2H).
4-(3,5-Диметоксифенил)-1-бутанол (5).
К размешиваемой суспензии литий-алюминийгидрида (LAH) (2.1 г, 55.3 ммоль) в безводном ТГФ (150 мл) при 0°C в сре- де аргона добавлялся раствор 4 (4.4 г, 18.5 ммоль) в безводном ТГФ (35 мл) в течение 10 минут. Реагирующая смесь перемешивалась энергично в течение 2.5 часов при той же самой температуре и затем загашена, при добавлении NaF (2.33 г, 55.5 ммоль), после чего было добавление по каплям 10%-ого водного NaOH. Смесь нагревалась до комнатной температуры, разбавлялась этилацетатом и водой, и была профильтрована через целит. Органический слой был отделён, а водная фаза извлекалась дважды с этилацетатом. Комбинированный органический слой промывался с соляным раствором и просушивался на MgSO4; растворитель был выпарен при пониженном давлении. Очистка колоночной флэш- хроматографией на силикагеле (50%-ый этилацетат в гексане) дала на выходе основное соединение 5 в виде бесцветного масла при 98%-ом выходе (3.8 g). 1H ядер- ный магнитный резонанс (CDCl3) δ 6.35 (d, J = 2.1 Гц, 2H, ArH), 6.30 (t, J = 2.1 Гц, 1H, ArH), 3.78 (s, 6H, OMe), 3.65 (t, J = 6.1 Гц, 2H, 1-H), 2.59 (t, J = 7.2 Гц, 2H, 4-H), 1.79-1.54 (m, 4H, 2-H, 3-H).
4-(3,5-Диметоксифенил)-1-бром-бутан (6).
К размешиваемому раствору 5 (3.07 г, 14.6 ммоль) и углеродистому четырехбромистому соединению (7.27 г, 21.9 ммоль) в безводном CH2Cl2 (73 мл) при -5°C в среде аргона был добавлен трифенилфосфин (6.5 г, 24.8 ммоль) порциями. После того, как добавление было завершено, смесь размешивалась ещё в течение 15 минут, после чего растворитель был удален в вакууме. Остаток очищался очищался колоночной флэш-хроматографией на силикагеле, используя 15%-ый диэтиловый эфир в гексане, как в растворителе для элюирования, чтобы получить основное соединение 6 в виде светло-жёлтого масла (3.44 г, 86%-ый выход). 1H ядерный магнитный резонанс (CDCl3) δ 6.34 (d, J = 2.0 Гц, 2H, ArH), 6.30 (t, J = 2.0 Гц, 1H, ArH), 3.78 (s, 6H, OMe), 3.42 (t, J = 6.4 Гц, 2H, 1-H), 2.59 (t, J = 7.3 Гц, 2H, 4-H), 1.95-1.69 (m, 4H, 2-H, 3-H).
5-(4'-бром-бутил)резорцин (7).
К раствору 6 (3.16 г, 11.6 ммоль) в сухом CH2Cl2 (90 мл) при -5°C в среде аргона добавлялось трёхбромистое соединение бора (25.5 мл, раствор 1 М в CH2Cl2). После добавления температура реакции постепенно поднималась до комнатной температуры, и перемешивание было продолжено до завершения реакции (6 часов). Непрореагировавшее трёхбромистое соединение бора было нейтрализовано добавлением метанола и льда при 0°C. Получившаяся смесь нагревалась при комнатной температуре и размешивалась в течение 40 минут; летучие компоненты были удалены в вакууме. Остаток разбавлялся с EtOAc и промывался с насыщенным раствором NaHCO3, водой, и соляным раствором. Органический слой просушивался на MgSO4, фильтровался, и сгущался при пониженном давлении. Очистка колоночной флэш-хроматографией (40%-ый EtOAc в гексане) давала на выходе 2.75 г (97%-ый выход) соединения 7 в виде белого тела. Т. пл. 40°C-42°C; 1H ядерный магнитный резонанс (CDCl3) δ 6.25(d,J=2.1Гц,2H,4-H,6-H),6.19(t,J=2.1Гц,1H, 2-H), 4.89 (br s, 2H, О), 3.41 (t, J = 6.7 Гц, 2H, 4 '-H), 2.53 (t, J = 7.6 Гц, 2H, 1 '-H), 1.90-1.84 (m, 2H), 1.76-1.70 (m, 2H); отношение масса/заряд масс-спектра (относительная интенсивность) 247 (М. ++ 2, 17), 245 (М. +, 18), 195 (32), 135 (46), 119 (100). Точная масса (FAB) рассчитано для C10H14BrO2 (MH +), 245.0177; найдено, 245.0177.
(-)-2-[3-3,4-транс-p-ментадиен-(1,8)-ил]-5-(4'-бром- бутил)резорцин (8).
К раствору 7 (1.38 г, 5.63 ммоль) в CH2Cl2 (50 мл) при 0°C в среде аргона добавалялась p- толуолсульфоновая кислота (96 мг, 0.56 ммоль), после чего добавлялся раствор (+)-цис/транс-p-мента-2,8-диен- 1-ол (1.03 г, 6.76 ммоль) в CH2Cl2 (6 мл). Реагирующая смесь перемешивалась при 0°C в течение 1.5 часов, когда тонкослойная хроматография показала полный расход исходного материала. Реагирующая смесь была разбавлена с диэтиловым эфиром, и эфирный раствор промывался с насыщенным раствором NaHCO3, водой, и соляным раствором. Органический слой просушивался на MgSO4, фильтровался, и сгущался при пониженном давлении. Очистка колоночной флэш-хроматографией (17%-ый диэтиловый эфир в гексане) дала на выходе 660 мг (31%-ый выход) основного соединения 8 в виде светло-жёлтого вязкого масла. 1H ядерный магнитный резонанс (CDCl3) δ 6.27 (br s, 1H, ArH), 6.16 (br s, 1H, ArH), 6.00 (br s, 1H, О), 5.56 (s, 1H, 2-H), 4.68 (br s, 1H, О), 4.66 (s, 1H, 9-H), 4.55 (s, 1H, 9-H), 3.84 (m as br d, J = 8.7 Гц, 1H, 3-H), 3.40 (t, J = 6.7 Гц, 2H, 4 '-H), 2.48 (t, J = 7.5 Гц, 2H, 1 '-H), 2.39 (td, J = 11.0 Гц, J = 3.1 Гц, 1 H, 4- H), 2.27-2.20 (m, 1H), 2.13-2.07 (m, 1H), 1.88-1.76 (m, 7H, особенно 1.80, s, 7-CH33), 1.75-1.69 (m, 2H), 1.66 (s, 3H, 10-CH3); отношение масса/заряд масс-спектра (относи- тельная интенсивность) 380 (М. ++ 2, 15), 378 (М. +, 15), 312 (33), 310 (34), 299 (100), 297 (100), 215 (31), 121 (27). Точно вычисленная масса для C20H27BrO2, 378.1194; найдено, 378.1192
(-)-4'-бром-Δ9-тетрагидроканнабинол (9).
К размешиваемому раствору 8 (290 мг, 0.77 ммоль) в безводном CH2Cl2 (15 мл) при 0°C в среде аргона был добавлен эфират трехфтористого бора (0.24 мл 1.92 ммоль). Перемешивание продолжалось в течение 40 минут, и реакция была загашена посредством добаления насыщенного раствора NaHCO3. Органический слой был отделён, и водная фаза была извлечена с CH2Cl2. Комбинированный органический слой промывался с соляным раствором и просушивался на MgSO4; растворитель испарялся при пониженном давлении. Очистка колоночной флэш-хроматографией на силикагеле (25%-ый диэтиловый эфир в гексане) давала на выходе 213 мг (73%-ый выход) основного соединения 9 в виде смолы. 1H ядерный магнитный резонанс (CDCl3) δ 6.29 (br s, 1H, 10Н), 6.26 (s, 1H, 4-H), 6.14 (s, 1H, 2-H), 4.86 (br s,1H,О),3.40(t,J=6.4Гц,2H,4'-H),3.20(masbrd,J= 11.0 Гц, 1H, 10a-H), 2.48 (t, J = 7.1 Гц, 2H, 1'-H), 2.24-2.10 (m, 2H), 2.01-1.60 (m, 9H, особенно 1.68, s, C9-CH3), 1.53- 1.25 (m, 4H, особенно 1.41, s, 6α-CH3), 1.09 (s, 3H, 6α- CH3); отношение масса/заряд масс-спектра (относительная интенсивность) 380 (М++ 2, 68), 378 (М+, 69), 365 (50), 363 (51), 339 (27), 337 (27), 299 (69), 297 (100), 295 (96), 215 (33). Точно вычисленная масса для C20H27BrO2, 378.1194; найдено, 378.1199. Анализ вычислен: C, 63.33; H, 7.17. Найдено: C, 62.94; H, 7.26.
5-(3,5-Диметоксифенил)-1,1,1-трифторо-пентан (13).
1-хлор-4,4,4-трифторбутан 10 был приготовлен из соответствующей хлорбутановой кислоты и четырехфтористого соединения серы под давлением при 60°C, согласно описанной процедуре. Раствор трифенилфосфина (32 г, 122.9 ммоль) и 10 (12 г, 81.9 ммоль) в бензоле (20 мл) был помещён в герметезированный баллон, и нагревался до 110°C в течение 40 часов. Затем смесь охлаждалась до комнатной температуры, и растворитель был выпарен,
чтобы получить на выходе 29 г (87 %) 11 в виде белого тела (Т. пл. 168°C-170°C), которое использовалось в следующем этапе без дальнейшей очистки. К суспензии 11(23 г, 56.4 ммоль) в безводном Et2O (60 мл) при 0°C, в среде аргона, n-бутиллитий добавлялся по каплям -(раствор 24.8 мл, 62 ммоль, 2.5 М в гексане). Смесь красного цвета размешивалась в течение 30 минут, и раствор
3,5-диметоксибензальдегида 1 (14.1 г, 84.9 ммоль) в Et2O (75 мл) добавлялся в течение 10 минут. После добавления реагирующая смесь нагревалась с обратным холодильником в течение 2 часов, растворитель был выпарен, и полученный остаток был извлечён с нагреванием с обратным холодильником бензола. Концентрат очищался колоночной хроматографией, с использованием 10%-ного хлороформа в гексане в качестве растворителя для элюирования, чтобы получилось 10 г (68%-ый выход) 12 1:2 цис/транс-смеси. H ядерный магнитный резонанс (CDCl3) δ 6.45 (d, J = 12.0 Гц, 1H, 5-H), 6.38 (br s, 3H, ArH), 5.62-5.56 (m, 1H, 4-H), 3.78 (s, 6H, OMe), 2.65-2.54 (m, 2H, 2-H), 2.27-2.14 (m, 2H, 3-H).
Раствор 12 (9.3 г, 35.7 ммоль) в абсолютном EtOH и 10%-ый Pd/C (на 10 мл) (30 мг) был помещён в прибор Parr (Parr Instrument Co, Moline, Иллинойс) и обработан в течение ночи с водородом при 60 psi. Катализатор был отфильтрован через целит, и фильтрат был выпарен при пониженном давлении, чтобы получилось основное соединение 13 в виде светло- жёлтого масла при 92%-ом выходе (8.6 г). 1H ядерный магнитный резонанс (CDCl3) δ 6.31 (br s, 3H, ArH), 3.77 (s, 6H, OMe), 2.57 (t, J = 7.0 Гц, 2H, 5-H), 2.14-2.01 (m, 2H, 2-H), 1.96-1.53 (m, 4H, 3-H, 4-H). Анализ вычислен: C, 59.53; H, 6.53. Найдено: C, 59.79; H, 6.82.
5-(5', 5', 5 '-трифтор-пентил)резорцин (14).
Раствор трёхбромистого соединения бора (3.93 мл, 41.6 ммоль) в бензоле (20 мл) добавлялся по каплям к раствору 13 (8.4 г, 32 ммоль) в бензоле (80 мл), который был ранее охлаждён до 0°C. Реагирующая смесь перемешивалась при комнатной температуре в течение 72 часов. Реакция загашивалась осторожным добавлением воды со льдом, и органическая фракция была промыта с 5%-ым раствором сульфита натрия, соляного раствора, и воды. После высушивания растворитель был удалён и полученный остаток очищался колоночной хроматографией, с использованием 1%-ого метанола в хлороформе в качестве - растворителя для элюирования, чтобы получить 7.4 г (99%-ый выход) 14 в виде светло-коричневого вязкого масла. 1H ядерный магнитный резонанс (CDCl3) δ 6.24 (br s, 2H, 4-H, 6-H), 6.20 (br s, 1H, 2-H), 2.40 (t, J = 6.8 Гц, 2H, 1 '-H), 2.10-1.92 (m, 2H, 4 '-H), 1.52-1.50 (m, 4H, 2 '-H, 3 '-H). Анализ вычислен: C, 56.41; H, 5.59. Найдено: C, 56.74; H, 5.88.
(-)-5',5',5'-трифторо-Δ8-тетрагидроканнабинол (15).
Раствор 14 (4.06 г, 17.3 ммоль), (+)-цис/транс-p-мента-2,8- диен-1-ол (3.3 г, 21.7 ммоль) и p-толуолсульфоновая кислота (0.4 г, 2.32 ммоль) в бензоле (100 мл) был нагрет с обратным холодильником в течение 4 часов. Реакция была загашена с 5%-ым раствором кислого углекислого натрия, и органическая фракция была промыта с водой. После высыхания растворитель был удалён в вакууме, и полученный остаток очищался колоночной хроматографией, используя 10%-ый диэтиловый эфир в гексане как растворитель для элюирования, чтобы получилось 4.3 г (67%-ый выход) 15 в виде жёлтой смолы. 1H ядерный магнитный резонанс (CDCl3) δ 6.26 (s, 1H, 4-H), 6.10 (s, 1H, 2-H), 5.42 (br s, 1H, 8-H), 3.18 (dd, J = 16.0 Гц, J = 3.5 Гц,1H,10α-Н),2.70(td,J=10.3Гц,J=4.5Гц,1H,10a- H), 2.47 (t, J = 7.0 Гц, 2H, 1 '-H), 1.70 (s, 3H, C9-CH3), 1.38 (s, 3H, 6α-CH3), 1.10 (s, 3H, 6α-CH3); отношение масса/заряд масс-спектра 368 (М. Анализ вычислен: C, 68.46; H, 7.39. Найдено: C, 68.21; H, 7.58.
(-)-5 '-фтор-Δ8-тетрагидроканнабинол (20).
К раствору 18 10,12,24 (303 мг, 0.92 ммоль) и 2,6-лутидина (0.53 мл, 4.58 ммоль) в хлористом метилене (6 мл) охлаждённом до 0°C, добавлялся трифлатный ангидрид (0.68 мл, 4.06 ммоль), и смесь размешивалась в течение 45 минут. Затем растворитель был удалён, используя поток азота, и полученный остаток очищался колоночной флэш- хроматографией на флоризиле. используя 5%-й диэтиловый эфир в гексане, чтобы получилось 319 мг (58 %) довольно чистого (-)-5'-трифторометилсульфонилокси-Δ -тетрагидроканнабинол трифлата 19. 1H ядерный магнитный резонанс (CDCl3) δ 6.66 (s, 1H, 4-H), 6.60 (s, 1H, 2-H), 5.44 (br s, 1H, 8-H), 4.53 (t, J = 6.5 Гц, 2H, 5 '-H), 2.88 (m, 2H, 10α-Н, 10a-H), 2.56 (t, J = 7.0 Гц, 2H, 1 '-H), 1.70 (s, 3H, C9-CH3), 1.39 (s, 3H, 6α-CH3), 1.11 (s, 3H, 6α-CH3). Смесь 19 (319 мг, 0.54 ммоль), криптофикса (203 мг, 0.54 ммоль) и фтористого калия (44 мг, 0.76 ммоль) в ацетонитриле (5 мл) размешивалась при 80°C в течение 40 минут. Пока реагирующая смесь была все еще тёплой, растворитель был удален, используя поток азота. Полученный остаток был растворён в диэтиловом эфире (5 мл), раствор был охлажден до 0°C, и литий-алюминийгидрид (2 мл, раствор на 1М в Et2O) добавлялся по каплям. Смеси позволили достигнуть комнатной температуры и раз- мешивали в течении 30 минут. Затем она была охлаждена до 0°C, загашена добавлением этилацетата, и нейтрализо- вана с 1N HCl. После экстракции с Et2O органическая фракция просушивалась, растворитель удалён при по- ниженном давлении, и продукт очищался колоночной хроматографией (15%-ый диэтиловый эфир в гексане), чтобы получилось 120 мг (67%-ый выход) 20 в виде смо- лы.1Hядерныймагнитныйрезонанс(CDCl3) δ6.27(s,1H, 4-H), 6.10 (s, 1H, 2-H), 5.42 (br s, 1H, 8-H), 4.43 (dt, JH-F = 47.3 Гц, 2H, 5 '-H), 3.16 (dd, J = 16.1 Гц, J = 3.4 Гц, 1H, 10α-Н), 2.70 (td, J = 10.3 Гц, J = 4.5 Гц, 1 H, 10a-H), 2.46 (t, J = 7.0 Гц, 2H, 1 '-H), 1.69 (s, 3H, C9-CH3), 1.37 (s, 3H, 6α-CH3 ), 1.10 (s, 3H, 6α-CH3 ).
Анализ 75.87; H, 8.79. Найдено: C, 75.64; H, 9.05.
(-)-11-фтор-Δ -тетрагидроканнабинол (23).
Фторид n-тетробутиламмония в ТГФ (1М, 12 мл, 12 ммоль) был перемешан с (-)-11-бром-Δ8-тетрагидроканнабинол ацетатом 22 (536 мг, 1.23 ммоль), и получившийся раствор нагревалмя до 60°C в течение 45 минут. После охлаждения смесь была влита в раствор 1N HCl (30 мл) и экстрагирована с диэтиловым эфиром. Органическая фракция просушивалась, растворитель был удален при пониженном давлении, и полученный остаток очищался колоночной хроматографией, используя хлороформ в качестве растворителя для элюирования, чтобы получилось 122 мг (30%-ый выход) основного соединения в виде смолы. 1H ядерный магнитный резонанс (CDCl3) δ 6.28 (s, 1H, 4-H), 6.11 (s, 1H, 2-H), 5.85 (s, 1H, 8-H), 4.75 (d, JH-F = 48.0 Гц, 2H, 11-Н), 3.46 (dd, J = 16.0 Гц, J = 3.5 Гц, 1 H, 10α-Н), 2.73 (td, J = 10.3 Гц, J = 4.5 Гц, 1 H, 10a- H), 2.45 (t, J = 7.1 Гц, 2H, 1'-H), 1.40 (s, 3H, 6α-CH3), 1.12 (s, 3H, 6α-CH3 ), 0.85 (t, J = 7.0 Гц, 3H, 5 '-H); отно- шение масса/заряд масс-спектра 332 (М. +). Анализ вычис- лен: C, 75.87; H, 8.79. Найдено: C, 76.20; H, 8.97.
2-(3,5-Диметоксифенил)-6-феноксигексан-2-ол (25).
Несколько капель раствора 4-феноксибутил бромида (7.63 г, 33.3 ммоль) в диэтиловом эфире (70 мл) добав- лялись к шламообразной смеси диэтилового эфира (10 мл), охлаждённой до 0°C, содержащей магниевую стружку (0.94 г, 39 ммоль) и кристалл йода. Реакция началась с лёгким нагреванием с обратным холодильником, и остающйся бром добавлялся по каплям в течение 3 часов. Когда бóльшая часть магния была израсходовалана, реагирующая смесь была охлаждена до 0°C и по каплям добавлялся раствор 3,5-диметоксиацетофенон (5 г, 27.7 ммоль) в диэтиловом эфире (на 50 мл). Смесь нагревалась с обратным холодильником в течение 1.5 часов и затем размешивалась при комнатной температуре в течение ночи. После охлаждения до 0°C, реакция была загашена с 50%-ым раствором хлористого аммония. Затем смесь была экстрагирована с диэтиловым эфиром, и органическая фракция промывалась с водой и соляным раствором. После высыхания растворитель был выпарен, и полученный остаток очищался колоночной хроматографией, используя 20%-ый диэтиловый эфир в гексане в качестве растворителя для элюирования, чтобы получилось 8.1 г (88%-ый выход) 25 в виде масла. 1H ядерный магнитный резонанс (CDCl3) δ 7.30-6.91 (m, 5H, OPh), 6.59 (s, 2H, ArH), 6.35 (s, 1H, ArH), 3.93 (t, J = 6.2 Гц, 2H, 6-H), 3.79 (s, 6H, OMe), 1.54 (s, 3H, 1-H), 1.89- 1.17 (m, 6H, 3-H, 4-H, 5-H). Анализ вычислен: C, 72.70; H, 7.93. Найдено: C, 73.05; H, 8.14.
2-(3,5-Диметоксифенил)-8-феноксиоктан-2-ол (26).
Смесь 6-феноксигексил бромид29 (6.17 г, 24 ммоль) и магниевой стружки (0.68 г, 28 ммоль) в диэтиловом эфире (70 мл) была преобразована в 6- феноксигексилмагний бромид, который впоследствии обработали с раствором 3,5-диметоксиацетофенон (3.71 г, 10.6 ммоль) в диэтиловом эфире (40 мл) согласно процедуре, описанной для соединения 25. Очистка колоночная хроматографией (20%-ый диэтиловый эфир в гексане) дала на выходе 6.63 г (90%-ый выход) 26 в виде масла. 1H ядерный магнитный резонанс (CDCl3) δ 7.78-6.85 (m, 5H, OPh), 6.47 (s, 2H, ArH), 6.34 (s, 1H, ArH), 3.90 (t, J = 6.3 Гц, 2H, 8-H), 3.80 (s, 6H, OMe), 1.53 (s, 3H, 1-H), 1.86-1.17 (m, 10- ый, 3-H, 4-H, 5-H, 6-H, 7-H); отношение масса/заряд масс-спектра 358 (М+). Анализ вычислен: C, 73.71; H, 8.44. Найдено: C, 73.99; H, 8.62.
2-(3,5-Диметоксифенил)-2-метил-6-феноксигексан (27).
Смесь раствора 25 (3.05 г, 9.2 ммоль) в гексане (12 мл, также содержашем несколько капель диэтилового эфира, чтобы увеличить растворимость субстрата) и концентрированная HCl (10 мл) размешивалась энергично при 40°C в течение 5 часов. 2 слоя были отделены, и органическая фракция была промыта с водой, насыщенным раствором кислого углекислого натрия, и соляным раствором. Затем органическая фракция просушивалась и растворитель был удалён при пониженном давлении, чтобы получился 2-хлор- 2-(3,5-диметокси-фенил)-6-феноксигексан (3.09 g), который использовался без дальнейшей очистки. К раствору вышеупомянутого хлорида (3.09 g) в толуоле (10 мл), охлаждённом до 0°C, был добавлен раствор триметилалюминия в толуоле (2N, 18 мл, 35.8 ммоль). Получившаяся смесь нагревалась с обратным холодильником в течение 6 дней, охлаждалась до 0°C, и была нейтрализовала медленным добавлением концентрированной HCl. Органическая фракция была промыта с водой, насыщенным раствором кислого углекислого натрия, и соляным раствором. После высыхания растворитель был удалён при пониженном давлении, и полученный остаток очищался колоночной хроматографией (5%-ый диэтиловый эфир в гексане), чтобы получилось 1.553 г (выход на 51.4 %) 2713,20 в виде масла. 1H ядерный магнитный резонанс (CDCl3) δ 7.30-6.80 (m, 5H, OPh), 6.48 (s, 2H, ArH), 6.30 (s, 1H, ArH), 3.87 (t, J = 6.3 Гц, 2H, 6-H), 3.78 (s, 6H, OMe), 1.76-1.57 (m, 6H, 3-H, 4-H, 5-H), 1.27 (s, 6H, гем-CH3). Анализ вычислен: C, 76.79; H, 8.59. Найдено: C, 76.44; H, 8.72.
2-(3,5-Диметоксифенил)-2-метил-8-феноксиоктан (27)
Смесь 26 (7.0 г, 19.5 ммоль) и концентрированной HCl (20 мл) размешивалась энергично в течение 7 часов при 50°C. После экстракции с гексаном и промывания с водой, насыщенным бикарбонатом натрия и соляным раствором, был получен и использовался без дальнейшей очистки 2-хлор-2-(3,5-диметоксифенил)- 8-феноксиоктан (6.06 g).
Метилирование было проведено, следуя процедуре, описанной для 27, растворяя хлорид в толуоле (18 мл) и используя триметилалюминий (2N раствор в толуоле, 33 мл, 65 ммоль). Получившийся раствор нагревался до 100°C и размешивался в течение 5 дней. После отработки полученный остаток очищался колоночной хроматографией (5%- ый диэтиловый эфир в гексане), чтобы получилось 2.75 г (40%-ый выход) 28 в виде масла. 1H ядерный магнитный резонанс (CDCl3) δ 7.30-6.85 (m, 5H, OPh), 6.47 (s, 2H, ArH), 6.28 (s, 1H, ArH), 3.90 (t, J = 6.3 Гц, 2H, 8-H), 3.79 (s, 6H, OMe), 1.26 (s, 6H, гем-CH3), 1.75-1.07 (m, 10Н). Анализ вычислен: C, 77.49; H, 9.05. Найдено: C, 77.27; H, 8.74.
5-(5'-Бром-1',1'-диметилпентил)резорцин (29).
К раствору 27 (2.14 г, 6.52 ммоль) в бензоле (100 мл), охлаждённом до 0°C, медленно добавлялось трёхбромистое соединение бора (1.5 мл, 15.8 ммоль). Смесь размешивалась при комнатной температуре. В часовых интервалах 24 часа и 48 часов ещё добавлялось трёхбромистое со- единение бора (1 мл, 10.6 ммоль и 0.5 мл, 5.3 ммоль, соответственно). Реакции позволили продолжиться в течение в общей сложности 80 часов. Затем реагирующая смесь была загашена водой со льдом, и органическая фаза была промыта с 5%-ым раствором сульфита натрия и соляного раствора. После высыхания был удалён растворитель, и полученный остаток очищался колоночной хроматографией (20%-ый этилацетат в гексане), чтобы получилось 1.73 г (выход 92.5 %) 2913,20 в виде вязкого масла. 1H ядерный магнитный резонанс (CDCl3) δ 6.38 (d,J=1.9Гц,2H,4-H,6-H),6.25(t,J=1.9гц1H,2-H), 3.33 (t, J = 6.6 Гц, 2H, 5 '-H), 1.82-1.50 (m, 6H), 1.23 (s, 6H, гем-CH3). Анализ вычислен: C, 54.37; H, 6.67. Найдено: C, 54.14; H, 7.01.
5-(7'-Бром-1',1'-диметилгептил)резорцин (30).
Раствор 28 (2.75 г, 7.72 ммоль) в бензоле (30 мл) обрабатывался трёхбромистым соединением бора (1.5 мл, 15.8 ммоль) как описано для соединения 29. Ещё трехбромистое соединение бора добавлялось 24 часа и 48 часов спустя (1 мл, 10.6 ммоль и 0.5 мл, 5.3 ммоль, соответственно). Смесь размешивалась при комнатной температуре в течение в общей сложности 72 часов. Остаток, полученный после отработки, очищался колоночной хроматографией (25%-ый этилацетат в гексане), чтобы получилось 2.2 г (90%-ый выход) 30 в виде вязкого масла. 1H ядерный магнитный резонанс (CDCl3) δ 6.38 (d, J = 1.9 Гц, 2H, 4-H, 6-H), 6.17 (t, J = 1.9 Гц, 1H, 2-H), 3.38 (t, J = 6.7 Гц, 2H, 7 '-H), 1.25 (s, 6H, гем-CH3), 1.79-1.06 (m, 10Н); отношение масса/заряд масс-спектра 314 (М+). Анализ вычислен: C, 57.15; H, 7.35. Найдено: C, 57.27; H, 7.64.
(-)-5'-Бром-1',1'-диметил-Δ8-тетрагидроканнабинол (31).
Раствор 29 (3.28 г, 11.43 ммоль), (+)-цис/транс-p мента-2,8-диен-1-ол (2.19 г, 14.4 ммоль) и p-- толуолсульфоновой кислоты (0.41 г, 2.4 ммоль) в бензоле (90 мл) нагревался с обратным холодильником в течение 4 часов. После процедуры, описанной для аналога 15, полученный остаток очищался колоночной хроматографией (25%-ый диэтиловый эфир в гексане), чтобы получилось 2.74 г (57%-ый выход) 3113,20 в виде смолы. 1H ядерный магнитный резонанс (CDCl3) δ 6.37 (s, 1H, 4-H), 6.22 (s, 1H, 2-H), 5.43 (br s, 1H, 8-H), 3.33 (t, J = 6.6 Гц, 2H, 5 '-H), 3.22 (dd, J = 16.1 Гц, J = 3.4 Гц, 1H, 10α-Н), 2.69 (td, J = 10.3 Гц, J = 4.5 Гц, 1H, 10a-H), 1.70 (s, 3H, C9- CH3), 1.39 (s, 3H, 6α-CH3), 1.22 (s, 6H, гем-CH3), 1.11 (s, 3H, 6α-CH3); отношение масса/заряд масс-спектра 420 (М. +). Анализ вычислен: C, 65.55; H, 7.89. Найдено: C, 65.37;
(-)-7'-Бром-1',1'-диметилгептил-Δ -тетрагидроканна-бинол (32).
Следуя процедуре, описанной для соедине- ния 31, раствор 30 (2.5 г, 7.94 ммоль), (+)-цис/транс-p-мента-2,8-диен-1-ол (1.52 г, 9.93 ммоль) и p- толуолсульфоновая кислота (0.283 г, 1.647 ммоль) были нагреты с обратным холодильником в бензоле (100 мл) в течение 4 часов. Остаток, полученный после отработки, очищался колоночной хроматографией (10%-ый диэтиловый эфир в гексане), чтобы получилось 2.32 г (65%- ый выход) 32 в виде смолы. 1H ядерный магнитный резонанс (CDCl3) δ 6.37 (s, 1H, 4-H), 6.21 (s, 1H, 2-H), 5.42 (brs,1H,8-H),3.35(t,J=6.7Гц,2H,7'-H),3.19(dd,J= 16.0Гц,J=3.4Гц,1H,10α-Н),2.69(td,J=10.3Гц,J= 4.4 Гц, 1H, 10a-H), 1.69 (s, 3H, C9-CH3), 1.38 (s, 3H, 6α- CH3), 1.20 (s, 6H, гем-CH3), 1.11 (s, 3H, 6α-CH3); отноше- ние масса/заряд масс-спектра 448 (М. +). Анализ вычислен: C, 66.81; H, 8.30. Найдено: C, 66.56; H, 8.40.
(-)-2-Йодо-Δ8-тетрагидроканнабинол (34).
(-)-Δ8-тет- рагидроканнабинол 33 (500 мг, 1.59 ммоль) в хлористом метилене (2 мл), йодистый натрий (1.2 г, 8.0 ммоль) и 18- крон-6 (42 мг, 0.16 ммоль) были добавлены к раствору m-хлорпербензоевой кислоты (410 мг, 2.38 ммоль) в хлористом метилене (10 мл). Смесь размешивалась при комнатной температуре в течение 30 минут, была раз- бавлена с диэтиловым эфиром, и промывалась с 10%- ым раствором метабисульфита натрия. Органическая фракция была затем промыта с водой и просушивалась. Растворитель был выпарен, и полученный остаток очи- щался колоночной хроматографией, с использованием циклогексана в качестве растворителя для элюирования, чтобы получилось 380 мг (54%-ый выход) 34 в виде ко- ричневой смолы. 1H ядерный магнитный резонанс (CDCl3) δ 6.39 (s, 1H, 4-H), 5.42 (br s, 1H, 8-H), 3.24 (dd, J=16.0Гц,J=3.3Гц,1H,10α-Н),2.74(td,J=10.4Гц,J = 4.3 Гц, 1H, 10a-H), 2.59 (t, J = 7.0 Гц, 2H, 1 '-H), 1.70 (s, 3H, C9-CH3), 1.38 (s, 3H, 6α-CH3), 1.09 (s, 3H, 6α-CH3), 0.86 (t, J = 6.9 Гц, 3H, 5 '-H); отношение масса/заряд масс-спектра 440 (М. +). Анализ вычислен: C, 57.28; H, 6.64. Найдено: C, 57.59; H, 6.82.
(-)-1'-Йодо-гептил-Δ8-тетрагидроканнабинол (36).
Просушенная в печи, 5 мл, круглодонная колба была оборудована магнитной мешалкой, и была обеспечена среда аргона. В колбу был заряжен спирт 35 (30 мг, 0.09 ммоль), сухой толуол (0.2 мл), трифенилфосфин (44 мг, 0.17 ммоль), имидазол (17 мг, 0.26 ммоль), и йод (43 мг, 0.17 ммоль). Получившаяся смесь размешивалась энергично при комнатной температуре в течение 3 часов. После завершения, выпаривание растворителя и очистка колоночной флэш-хроматографией на силикагеле (5%-ый диэтиловый эфирный петролейный эфир) дали на выходе 25 мг (64%-ый выход) основного соединения 36 в виде вязкого масла. 1H ядерный магнитный резонанс (CDCl3) δ 6.46, 6.44, 6.31, 6.29 (s, 0.5Н каждый, смесь диастереоизомеров, ArH), 5.43 (d, J = 3.9 Гц, 1H, 8-H), 4.95-4.93 (m, 1H, смесь диастереоизомеров, 1′-CH- ),4.76(s,1H,О),3.18(dd,J=16.9Гц,J=4.0Гц,1H, 10α-Н), 2.67 (ddd как td, J = 10.6 Гц, J = 4.6 Гц, 1H, 10a- H), 2.26-2.16 (m, 3H, 7α-Н, 10β-Н, 7β-Н), 2.03-1.66 (m, 6H, 6a-Н, 2 '-CH2-, особенно 1.66, s, 9-CH3), 1.42-1.24 (m, 11H, 3 '-CH2-, 4 '-CH2-, 5 '-CH2-, 6 '-CH2-, 6α-CH3), 1.09 (s, 3H, 6α-CH3), 0.85, 0.83, (t, J = 7.1 Гц, 3H, смесь диастереоизомеров, 7 '-CH3).
Пробирный анализ cвязывания меченого лиганда
Были подготовлены синаптосомальные мембраны переднего мозга от замороженных мозгов крысы методом Dodd и др30 и они использовались, чтобы оценить химические связи аналогов каннабиноида с центром связывания CB1. Смещение специфично насыщенного тритием CP-55,940 от этих мембран использовалось, чтобы определить значения IC5 0 для испытываемого соединения. Пробирный анализ проводился на 96-луночном планшете микрофильтра. Образцы были профильтрованы, с использова- нием Packard Filtermate Harvester (Packard Instrument Co, Meriden, Коннектикут) и планшета Whatman GF/B (Whatman, Кент, Великобритания), альбумин из 0.5 % бычьей сыворотки (BSA) был включён в промывающий буфер. Радиоактивность обнаруживалась, используя коктейль сцинтилляции MicroScint 20 (Packard Instruments) который добавлялся к высушенным фильтровальным пластинам и подсчитывалась с применением Packard Instruments Top Count.
Данные были собраны от 3 независимых экспериментов между и специфическим связыванием 100% и 0 % для [3H]CP-55,940, определявшимся с использованием 0 и 100 нМ CP-55,940. Нормализованные данные от 3 независимых экспериментов были скомбинированы и проанализированы с использованием логистического уравнения с 4 параметрами, чтобы получить значения IC50, которые были преобразованы в значения Ki, используя допущения Cheng и Prussoff.
Молекулярное Моделирование
Вычислительные исследования выполнялись, используя программу Insight II/Discover на рабочей станции SGI Fuel (SGI, Mountain View, Калифорния). Каждый аналог сначала был создан с углами связи и длинами химической связи, дополненными функцией Builder feature (Строителя молекулы) и заданным полем сил CFF91. Затем использовались молекулярная механика и динамика, для исследования низкоэнергетических конформационных изомеров, был назначен интервал 1 фемтосекунды на каждое повторение. Сначала каждая структура была минимизирована, используя метод самого крутого спуска для 100 повторений, до тех пор, пока максимальная производная не станет меньше 0.1 ккал/моль. Затем, молекулярная динамика была инициализирована на 1000 повторений при 1000 K, чтобы уравновесить каждый аналог. После приведения в равновесие, процедура динамики была продолжена для 300 000 повторений при той же самой температуре чтобы взять полную выборку доступного конформационного пространства для каждого аналога. При 1000 итеративных интервалах атомные координаты регистрировались в файл архива в общей сложности для 300 конформаций на аналог. Вслед за этапом динамики, конформационные изомеры в каждом файле архива были подвергнуты минимизации, используя метод самого крутого спуска для 100 повторений, после чего шёл метод сопряжённого градиента для 5000 повторений, до тех пор, пока максимальное отклонение не стало менее 0.001 ккал/моль.
Значения двугранного угла (C2-C3-C1'-C2' и C3-C1'-C2'-C3') были получены из каждого конформационного изомера для анализа. Кроме того, контуры объёма боковой цепи каждого аналога рассчитывались с много- контурным модулем TRIPOS SYBYL34, для того, чтобы наблюдать за местом, занятым каждой боковой цепью.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Способности синтезируемых аналогов вытеснять меченный радиоактивным изотопом CP-55,940 из очищенных синаптосом переднего мозга крысы, определялись, как описано в разделе Методы и Материалы. Значения Ki, рассчитанные от соответствующих кривых замещения, перечислены в Таблице 1 и служат индикаторами для химических связей этих аналогов для рецепторов CB1.
Поверхностное изучение химических связей показывает некоторые интересные корреляции функции структуры, которые могут быть подытожены следующим образом:
• Замещение галогена в концевом атоме углерода боковой цепи приводит к усилению в химической связи лиганда для CB1 с большими галогенами, имеющими более высокие химические связи. Таким образом, для C1'-незамещённого ряда, где боковая цепь может быть представлена (CH ) R, порядок химических связей для различных заместителей R, следующий: CH2I = CH2Br> бром> CF3> CH3> CH2F. Этот порядок хорошо коррелируется с размером сегмента концевого атома углерода цепи, предполагая гидрофобное взаимодействие с соответствующим участком на рецепторе CB1.
Наши результаты показывают, что у аналогов 5'- йодопентил (17b) и 5'-бромпентил (17a) - самые высокие химические связи, в то время как у соединения с метиловыми группами ((-)-Δ8-THC) и фторметиловыми группами (20) – они самые низкие. Также, 4'-бром-аналог (9) взаимодействует более эффективно, чем исходное соединение (-)- Δ9-THC, отражая более крупный объём группы
брома по сравнению с метиловой группой.
• Введение 1',1′-диметилового заместителя усиливает взаимодействия галоидированной боковой цепи с CB1, как это наблюдается в 1',1 '-диметил- 5'-бромпентиловом (31) и 1',1'-диметил-7'- бромгептиловом (32) аналогах. У аналога пентила есть несколько более высокая химическая связь чем у соответствующего аналога гептила, можно предположить, что оптимальная длина цепи для боковой цепи ω-брома лежит в пределах длин цепи из 5 и 7 углеродов. Наличие 1',1'-диметиловой замены в цепи приводит к более чем 15-кратному увеличению химической связи. Это наблюдение является конгруэнтным с наличием гидрофобного подучастка в CB1, как было обсуждено в наших предыдущих публикациях26,36,37 Однако, ситуация очень отличается на 1'-йодо-аналоге (36), где наличие одной йодо-группы приводит к серьёзному уменьшению химической связи с рецептором CB1. Эта находка отражает либо неспособность подучастка CB1 разместить большую группу, такую как йодо-заместитель или наличие эффекта, который галоген может иметь на предпочтительной конформации боковой цепи.
• Введение фторозамещенной группы в 11-позицию (23) приводит к 2-кратному уменьшению связы- вающей способности.
• Введение 2-йодо заместителя (34) приводит к 2- кратному уменьшению химической связи. Этот результат может быть отнесён к пространственным эффектам, либо он связан с изменениями в конформации боковой цепи или с относительно малым неблагоприятным взаимодействием объёмистой йодо-группы с центром связывания CB1. Другой возможный неблагоприятный вклад 2-йодо группы – её электронное воздействие на группу фенольного гидроксила каннабиноидов.

Рис. 1. Контуры объёма боковой цепи аналогов 9, 17a, 31, и 32 (слева направо). Здесь изображено только фенольное А кольцо каннабиноидов. Чтобы более эффективно представить фармакофорное место терминала боковой цепи, двугранный угол C2-C3- C1′-C2′ был зафиксирован на -120 градусах для показанных аналогов. Это значение представляет собой самые низкоэнергетиче- ские конформационные изомеры энергии для 31 и 32. Соответствующие конформационные изомеры для 9 и 17a представляют собой конформации только немногим более высокие, чем таковые с самой низкой энергией (ΔG = 1.13 ккал/моль). (Интерак- тивный вариант доступен в интернет-версии).
Вышеупомянутые данные дают интересные добавления в ныне доступную связь структура-активность для боковой цепи каннабиноида. Чтобы графически изобразить эти результаты, мы использовали вычислительные методы, которые позволили нам более точно определять стереоэлектронные необходимые условия этого фармакофора, Мы выполнили вычисления молекулярной механики и динамики на аналогах: 4'-бромбутил (9), 5'- бромпентил (17a), 1',1'-диметил-5'-бромпентил (31), 1',1'- диметил-7'-бромгептил (32), и 1'-йодогептил (36) и определили их соответствующие низкоэнергетические конформационные изомеры. Впоследствии, мы сосредоточились на C2-C3-C1'-C2' и C3-C1'-C2'-C3' – двугранных углах. Наши результаты показывают, что, за исключением аналога 1'-йодогептила (36), конформации боковых цепей показывают схожие предпочтения, которые могут использоваться как основание для объяснения различий в химическом связывании CB 1 для конформационных изомеров. Увеличенная химическая связь 17a против 9 является вероятно результатом увеличения длины боковой цепи от (CH2)4Br до (CH2)4CH2Br. Действительно, осмотр объёмов боковой цепи на Рис. 1 показывает более обширное место, занятое оконцовкой боковой цепи 17a. Это место может соответствовать гидрофобному региону в пределах связывающего кармана CB1, который будучи занятым, наделяет лиганд более высокой химической связью.
Этот гидрофобный регион вероятно является оптимальным для замещения концевого галогена на боковых цепях C5 или C6. Больший объём оконцовки боковой цепи C7 соединения 32 относительно 31 (Рис. 1) приводит к небольшому уменьшению связывающей способности CB1. Увеличенные химические связи всех C′-диметил замещённых аналогов, могут быть приписаны их взаимодействию с соответствующим подучастком в пределах центра связывания CB1, как обсуждено в наших предыдущих публикациях. Дополнительная причина для этих увеличенных химических связей может быть связана с предпочтительными конформациями этих лигандов вокруг связи C3-C1'. Как показано в Таблице 2, в отсутствие двух 1',1′-метиловых групп в 17a, двугранный угол C2-C3-C1'-C2' равен приблизительно ±90 градусам. Однако, во всех 1',1′-диметиловых аналогах, таких, как 31, значение этого двугранного угла близко к 60°, что может также соответствовать фармакофорной конфор- мации боковой цепи и привести к более высоким хими- ческим связям с CB1. Наконец, сравнение зеркальных изомеров R и S 1'-йодо аналога (36) показывает, что их значения двугранного угла, как ожидается, такие же по величине, но противоположные по знаку. Как было указано ранее, у 36 имеется слабая химическая связь с CB1, по сравнению с другими 4 аналогами. В то время, как на- личие C1' йода может вызвать некоторые неблагоприятные электростатические взаимодействия в пределах связывающего кармана CB1, его присутствие также даёт двугранный угол для C3-C1'-C2'-C3' ±165 градусов, значение, которое не присутствует ни в одном из конформационных изомеров других 4 аналогов (Рис 2). Возможно, эта конформация может препятствовать лиганду в уча- стии в благоприятном взаимодействии с CB1, таким образом приводя к относительно низкой химической связи для этого рецептора.
Таблица 2. Значения двугранного угла конформационного изомера для аналогов 9, 17a, 31, 32, и 36 (Зеркальные изомеры R и S) *

*Число в круглых скобках представляет число конформационных изомеров данного аналога, имеющего соответствующий двугранный угол.

Рис 2. Низкоэнергетическая конформация аналога 31 (слева) по сравнению с зеркальным изомером S аналога 36. Величины двугранного угла C2-C3-C1′-C2′ и C3-C1′-C2′-C3′ показаны жёлтым. (Интерактивный вариант этого рисунка есть в Интернет- версии).
More Thread Same Category
- Синтетика vs натур.
- Побочный эффект от канабба.
- Гриндер своими руками.
- А что вы делаете??? Когда нету курить!!!!!
- микс vs опиаты или как микс перестал быть лёгким наркотиком.
- Хранение Натуральных Каннабиноидов: Важные Нюансы и Советы
- Растение Cannabis краткая история каннабиса и основы его использовияан
- Влияние на человека тетрагидроканнабинола | бошки канапли гарика на нервную систему
- Реагент в нос.
- Каннабис или марихуана?